Xenon
| Xenon | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 Et xenon-fyldt gasudladningsrør med en let blålig glød | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Periodiske system | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Generelt | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomtegn | Xe | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomnummer | 54 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronkonfiguration | 2, 8, 18, 18, 8 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Udseende | Farveløs gas, udviser en blå glød i et elektrisk felt | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gruppe | 18 (Ædelgasser) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Periode | 5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Blok | p | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS-nummer | 7440-63-3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomare egenskaber | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atommasse | 131,293 u | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kovalent radius | 130 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Van der Waals-radius | 216 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronkonfiguration | [Kr] 4d10 5s²5p6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektroner i hver skal | 2, 8, 18, 18, 8 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ioniseringspotentiale | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1. ioniseringspotentiale | 1170,4 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2. ioniseringspotentiale | 2046,4 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3. ioniseringspotentiale | 3099,4 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kemiske egenskaber | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidationstrin | 0, +1, +2, +4, +6, +8 (sjældent mere end 0) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronegativitet | 2,6 (Pauling-Skala) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fysiske egenskaber | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tilstandsform | Gas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Krystalstruktur | Kubisk, F-centreret | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Massefylde (gas) | 5,894 g/L | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Smeltepunkt | -111,7 °C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kogepunkt | -108,12 °C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Smeltevarme | 2,27 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fordampningsvarme | 12,64 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Varmeledningsevne | 0,00569 W/(m · K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Xenon er det 54. grundstof i det periodiske system, og har det kemiske symbol Xe. Xenon er en tung, farveløs og lugtfri ædelgas, og findes i små mængder i jordens atmosfære.[1] Xenon er generelt meget lidt reaktiv, men xenon deltager i nogle få kemiske reaktioner, såsom dannelsen af xenonhexafluoroplatinat, som var den første forbindelse med en ædelgas.[2][3][4]
Naturligt forekommende xenon består af 9 stabile isotoper. Herudover kendes over 40 ustabile isotoper, som gennemgår radioaktivt henfald. Isotopsammensætningen af xenon er et vigtigt værktøj i studiet af den tidlige historie om vores solsystem.[5] Xenon-135 er produktet af kernefission, og absorberer neutroner i en atomreaktor.[6]
Xenon bliver brugt i blitzlamper,[7] buelamper[8] og til universel narkose.[9] Den første excimerlaser brugte et xenon-dimer-molekyle (Xe2) som dets lasermedium[10] og de tidligste laserkonstruktioner brugte blitzlamper til at excitere, eller "pumpe" lasermediet. [11] Xenon bliver også brugt til at lede efter hypotetiske WIMP (weakly interacting massive particles)[12] og som drivmiddel i ion-motorer til rumfartøjer.[13]
Historie
Xenon blev opdaget i England af William Ramsay og Morris Travers den 12. juli 1898, kort efter at de havde fundet to andre ædelgasser, krypton og neon. De fandt xenon i en destillationsrest, efter de havde fordampet dele af flydende luft[14][15]. Ramsay forslog at den nye gas skulle kaldes xenon efter det græske ord ξένον [xenon], intetkøns singularis form af ξένος [xenos] som betyder fremmed, mærkelig eller vært[16][17]. I 1902 anslog Ramsay, at mængdeforholdet af xenon i jordens atmosfære er 1 til 20 millioner.[18]
I 1930'erne begyndte ingeniør Harold Edgerton at undersøge stroboskop-teknologi til højhastigheds-fotografering: Det ledte til at han opfandt xenon-blitzlyset, hvor lys dannes ved at sende en kortvarig elektrisk strøm igennem et rør fyldt med xenon. I 1934 kunne Edgerton skabe lysglimt så kort som et mikrosekund med denne metode[7][19][20].
I 1939 begyndte Albert R. Behnke Jr. at undersøge årsagen til "fuldesygen" blandt dybhavsdykkere. Han eksperimenterede med forskellige luftblandinger i sine forsøgspersoners indåndingsluft, og opdagede at dette fik dykkerne til at fornemme en dybdeændring. Ud fra hans resultater konkluderede han, at xenon kunne bruges som en narkose. Selvom Lazharev fra Rusland tilsyneladende undersøgte xenon som en narkose i 1941, så blev den første rapport som bekræftede xenon-narkose først udgivet i 1946 af J. H. Lawrence, som udførte forsøg på mus. Xenon-narkose blev første gang brugt som en operationsnarkose i 1951 af Stuart C. Cullen, som med succes opererede to patienter.[21]
I 1960 opdagede fysiker John H. Reynolds, at isotopfordelingen af xenon i visse meteoritter afviger fra xenon her på Jorden; meteoritterne indeholdte mere 129Xe. Han udledte at det var et henfaldsprodukt, af den radioaktive isotop 129I. Denne isotop spaltes langsomt af kosmisk stråling og nuklear fission, men den produceres kun i større mængder i en supernova-eksplosion. Da halveringstiden på 129I (16 millioner år) er forholdsvis kort på en kosmologisk skala, formodes det, at der har indtruffet sådan en eksplosion relativt kort tid før Solsystemet blev dannet, hvorved "råmaterialerne" til solsystemet (og dermed også meteoriterne) er blevet beriget med 129I. Denne supernova kan meget vel også have startet det kollaps af en interstellar gas- og støvsky, der ledte til vores solsystems dannelse.[22][23]
Xenon og de andre ædelgasser er tidligere blevet betragtet som fuldstændig kemisk inaktive, og ude af stand til at danne forbindelser med andre stoffer. Men mens Neil Bartlett underviste ved University of British Columbia, opdagede han at gassen platinhexafluorid (PtF6) var et stærkt oxidationsmiddel, som kunne oxidere ilt (O2) og derved danne dioxygenylhexaflouroplatinat (O2+[PtF6]−)[24]. Idet Ilt og xenon næsten har samme første ioniseringspotentiale, indså Bartlett at platinhexafluorid måske også kunne oxidere xenon. Den 23. marts 1962 blandede han de to gasser og dannede den første kendte forbindelse af en ædelgas, xenonhexaflouroplatinat[25][4]. Barlett troede dens sammensætning var Xe+[PtF6]−, men senere forskning viste at det muligvis var en blanding af forskellige xenon-holdige salte[26][27][28]. Sidenhen er mange andre xenon-forbindelser blevet opdaget[29] og nogle ædelgasforbindelser af argon, krypton og radon er også blevet identificeret, herunder argonflourohydrid (HArF)[30], kryptondiflourid (KrF2)[31][32] og radonflourid (RnF2)[33].
Forekomst
Der findes små mængder xenon i jordens atmosfære, 0,087±0,001 ppm (μL/L)[34], samt i gasser afgivet fra nogle mineralkilder. Nogle radioaktive xenonisotoper, for eksempel 133Xe og 135Xe, er produceret ved neutron bestråling af fissible materialer inde i en atomreaktor.[2]
Kommercielt produceres xenon som et biprodukt ved separation af luft til ilt og nitrogen. Separationen foregår ved fraktionsdestillering i et dobbelt søjle anlæg. Den flyende ilt som der bliver produceret indeholder en lille mængde krypton og xenon. Ved yderligere fraktionsdestillering, kan man opnå en blanding på 0,1%-0,2% af krypton og xenon, som ekstraheres enten ved hjælp af adsorption på silicagel eller ved destillering. Til sidst separeres blandingen af krypton og xenon ved hjælp af destillering[35][36]. Til ekstraktion af 1 liter xenon fra luften, bruges der 220 W·h[37]. Globalt blev der i 1998 produceret cirka 5000-7000m3 xenon[38] og på grund af dette, er xenon meget dyrere end de andre lette ædelgasser. Cirkaprisen for at købe små mængder ædelgasser i Europa i 1999 var: 10€/L for xenon, 1€/L for krypton og 0,2€/L for neon[38].
Xenon er relativt sjældent i solens atmosfære, på jorden og i asteroider og kometer. Atmosfæren på planeten Mars har samme mængde xenon som på Jorden, nemlig 0,08 ppm,[39] men i Mars' atmosfære er der en større andel af 129Xe i forhold til jordens- og solens atmosfære. Da denne isotop er blevet dannet ud fra radioaktivt henfald, har man antaget at Mars har mistet det meste af dens oprindelige atmosfære, højst sandsynligt inden for de første 100 millioner år efter planeten blev dannet[40][41]. Hvis man så ser på planeten Jupiter, som har usædvanligt meget xenon i dens atmosfære, omkring 2,6 gange så meget som solens.[42]. Denne store mængde xenon i Jupiters atmosfære er endnu ikke forklaret, men grunden kunne være en hurtig og tidlig opbygning af planetesimaler, før den protoplanetariske skive begyndte at opvarmes.[43] (Ellers var xenon ikke blevet fanget i det tidlige solsystems mange is-planetesimaler).
Inden for solsystemet er den nukleare fraktion for alle xenons isotoper 1,56 × 10−8 eller 1 ud af 64 millioner af dens totale masse.[44] Grunden til at der ikke er så meget xenon i jordens atmosfære, kan muligvis forklares af den kovalente binding af xenon til ilt i kvarts, dermed reduceres de udgående gasser af xenon, som ellers ville have endt i atmosfæren.[45]
I modsætning til de lettere ædelgasser, så dannes xenon ikke i en stjernes normale stjernenukleosyntese-proces. Grundstoffer som er tungerer end 56Fe forbruger energi i stedet for at frigive energi, så der ikke er nogen energimæssig "gevinst" for en stjerne i at danne xenon.[46] I stedet for dannes der mange isotoper af xenon ved en supernova-eksplosion.[47]
Karakteristika
Et xenon-atom er karakteriseret til at have en kerne med 54 protoner. Ved standardtemperatur og -tryk, har rent xenon gas en densitet på 5,761 kg/m3, dvs. omkring 4,5 gange overflade densiteten af jordens atmosfære, 1,217 kg/m3[48]. På flydende form har xenon en densitet op til 3,100 g/mL, hvor densitets maksimum forekommer ved trippelpunktet[49]. Under de samme forhold, har xenon på fast form densiteten 3,640 g/cm3, hvilket er højere end gennemsnits densiteten for granit, 2,75 g/cm3[49]. Ved tryk i gigapascal størrelsen, tvinger man xenon i en metallisk fase.[50]
Xenon hører til gruppen af nul-valens grundstoffer, også kendt som ædle- eller inerte gasser. Xenon er inert ved de fleste af de mest kendte kemiske reaktioner (for eksempel forbrænding), på grund af at den har 8 elektroner i yderste skal. Dette giver en stabil lav energi konfiguration hvor de ydre elektroner sidder tæt sammen.[51] Men xenon kan oxideres ved brug af kraftige oxidationsforbindelser (for eksempel platinhexafluorid) og mange xenonforbindelser er blevet syntetiseret.
I et rør fyldt med xenon-gas, udsender xenon et blåt eller lavendelblå agtigt skær når man sætter strøm til. Skæret som xenon udsender, strækker sig over det visuelle spektrum,[52] dog er linjerne i det blå område kraftigere og grunden til at det er et blåligt skær.[53]
Isotoper
Naturligt forekommende xenon består af 9 isotoper (man har forudsagt at isotoperne 124Xe, 134Xe og 136Xe gennemgår et dobbelt betahenfald, men da ingen nogensinde har observeret dette, har man antaget at de er stabile[54][55]). Xenon er det grundstof med næstflest stabile isotoper, kun overgået af tin som har 10 stabile isotoper.[56]. Ud over de 8 stabile isotoper, så kendes over 40 ustabile isotoper som er blevet undersøgt.
Den ikke-naturlige isotop 135Xe har en væsentlig betydning for driften af nuklear fissionsreaktorer (atomreaktorer). 135Xe har et stort neutrontværsnit for termoneutroner, 2,65×106 barner, så den fungerer som en neutron absorbere eller "gift" som kan sænke hastigheden på kernereaktionen eller stoppe den helt, efter den har været i drift i en periode. Dette blev opdaget i de første atomreaktorer som blev bygget i forbindelse med det amerikanske Manhattan Project til plutoniumproduktion.
I atomreaktorer findes høje koncentrationer af stråling fra radioaktive xenonisotoper, på grund af udledningen af fissionsgasser som stammer fra sprækkede brændselsstave eller fra spaltningen af uran i kølevandet.
Da xenon er et sporingsstof for to moderisotoper, er xenon et værdifuldt værktøj når det kommer til at studere dannelsen af solsystemet, da man kan se på forholdet af xenonisotoper i metoritter. Iod-xenon datering giver tiden imellem nukleosyntesen til kondensationen af faste objekter fra solsystemets dannelse. Xenonisotoper er også et vigtigt værktøj til at forstå jordisk differentiation.[5]
Forbindelser
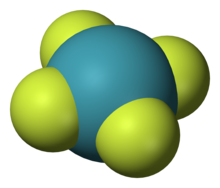
Den første kemiske xenonforbindelse blev syntetiseret i 1962 og var xenonhexafluoroplatinat[25]. Efterfølgende er der blevet syntetiseret mange andre xenon forbindelser, blandt andet: xenondifluorid (XeF2), xenontetrafluorid (XeF4), xenonhexafluorid (XeF6), xenontetroxid (XeO4) og natriumperxenat (Na4XeO6). Et yderst eksplosivt stof, xenontrioxid (XeO3) er der også blevet lavet. Størstedelen af de mere end 80 kendte xenon forbindelser,[57][58] indeholder enten elektronnegativt flour eller ilt. Når xenon er bundet til andre atomer (såsom brint og carbon), er de oftest en del af det molekyle som indeholder flour eller ilt[59]. Nogle xenon forbindelser er farvet, men de fleste er farveløse[57].
I 1995 annoncerede Markku Räsänen og hans medarbejdere fra Helsinkis Universitet, Finland, en ny xenonforbindelse, xenondihydrid (HXeH) og senere xenonhydridhydroxid (HXeOH), hydroxenoacetylen (HXeCCH) og andre xenon indeholdende molekyler.[60][61] I 2008 annoncerede Khriachtchev forbindelsen HXeOXeH dannet ved fotolyse af vand i en kryogen xenon matrix[62]. Deuterium molekylerne: HXeOD og DXeOH er også blevet fremstillet[63] .

Ud over at xenon kan danne kemiske forbindelser, så kan xenon også danne klatrater (et stof hvor xenon atomerne bliver fanget inde i det krystalliske gitter af en anden forbindelse). Et eksempel på dette er xenonhydrat (Xe·5,75H2O), hvor xenonatomerne besætter ledige pladser i vandmolekylets gitter[64]. Der er også fremstillet en deutereret version af dette hydrat.[65] Sådanne hydrat klatrater kan også forekomme naturligt, under den betingelse at der skal være et højt tryk, for eksempel i Lake Vostok under den antarktiske is.[66] Klatrat dannelse kan også bruges til fraktionsdestillering af xenon, argon og krypton.[67] Xenon kan også danne endohedrale komplekser, hvor xenonatomet er fanget inde i fullerenmolekylet. Når xenon atomet er fanget i fulleren, kan man overvåge det ved hjælp af 129Xe Kernemagnetisk resonans (NMR) spektroskopi. Ved at bruge denne teknik kan man analysere de kemiske reaktioner i fullerenmolekylet, på grund af xenon atomets følsomhed overfor kemisk skift i dens miljø. Dog kan xenon atomet også have en elektrisk indflydelse på reaktiviteten af fullerenmolekylet.[68]
Anvendelser
Selvom xenon er en sjældent og dyrt at udvinde af jordens atmosfære, så anvendes xenon stadig til en række formål.
Belysning og optik
Gasudladningslamper
Xenon bliver brugt i lysudledende apparater såsom: xenon blitzlys, som bliver brugt i fotografiske blitz- og stroboskoplamper[7]. Til at eksistere lasere i dets aktive lasermedium, hvilket generer koherens lys[69], og nogen gange brugt i bactericid lamper[70]. I den første solid-state laser, som blev opfundet i 1960, blev exciteret af en xenon blitz lampe[11] og i lasere brugt til inertifusion, bruger også en xenon blitz lampe[71].
Kontinuerlig, kort buet, høj tryks xenon bue lamper, kan næsten sammenlignes med farve temperaturen for sol lyset ved middagstid og bliver derfor brugt i sol simulatorer.
Det er kromaciteten af disse lamper, som tilnærmer sig en opvarmet sortlegemeradiator, som har samme farvetemperatur som solen. Efter de blev introduceret i 1940'erne, begyndte disse lamper at erstatte carbon-buelamper i filmprojektorer[8]. Mere specifikt finder man carbon-buelamper i 35mm og IMAX filmprojektorer samt selvkørende HID forlygter. Disse buelamper er en perfekt kilde til ultraviolet stråling med en kort bølgelængde og har en kraftig emission nær det infrarøde spektrum, hvilket bliver brugt i nogle nattesynssystemer.
Den individuelle celle i en plasmaskærm er en blanding af xenon og neon, som bliver lavet om til plasma ved hjælp af elektroder. Vekselvirkningen af plasmaet sammen med elektroderne genererer ultraviolette fotoner, der derved eksisterer med den fosforbelagte forside af skærmen.[72][73]
Xenon bliver også brugt som et "startergas" i højtryks-natriumlamper. Xenon har den laveste termiske konduktivitet samt den laveste ionisationspotentiale af alle de ikke-radioaktive ædelgasser. Og da det er en ædelgas, så reagerer den ikke med den andre kemiske reaktioner som der er, når lampen bruges. Den lave termiske konduktivitet minimere det termiske tab inde i lampen når den er i funktion og dens lave ionisation potentiale gør at lampen er nemmere at starte op når den er kold, da det væsentligt sænker den spænding der skal til for at få isolatoren til at blive elektrisk ledende[74].
Laser
I 1962 opdagede en gruppe forskere på Bell Laboratories at xenon kunne bruges i lasere[75] og senere fandt de ud af at laseren blev kraftigere hvis man tilførte helium til lasermediumet.[76][77] Den første excimerlaser brugte en xenon dimer (Xe2), som fik tilført strøm fra en stråle af elektroner for at producere stimuleret emission ved en ultraviolet bølgelængde på 176 nm[10]. Xenonchlorid og xenon flurid har også været brugt til excimer (eller, mere korrekt, exciplex) lasere[78]. Xenon chlorid excimerlaseren bliver blandt andet brugt i enkelte tilfælde af hudlæger.[79]
Narkose
Xenon bliver også brugt som narkose selvom det er en dyre løsning. Trods prisen, så er narkosemaskiner som bruger xenon begyndt at kunne ses på det europæiske marked.[80] Der er forslået to virkemidler for xenon-narkose. Den første involverer hæmning af calcium ATPase pumpen, hvilket går ud på at xenon fjerner calcium (Ca2+) i cellemembranens synapse.[81] Dette resulterer i en tilpasningsændring når xenon binder sig til den ikkepolære side inde i proteinet.[82] Det andet virkemiddel fokuserer på de ikke specifikke vekselvirkninger mellem narkosemiddelet og lipid membranen.[83]
Xenon har en minimum alveolær koncentration (MAC) på 71 %, hvilket gør den 50 % mere kraftig end N2O som et narkosemiddel[9]. Derfor kan det bruges i koncentrationer med ilt, hvilket formindsker chancen for hypoxia. I modsætning til lattergas (N2O), så er xenon ikke en drivhusgas og er derfor anset som et miljøvenligt narkosemiddel. På grund af den høje pris på xenon, er det nødvendigt med et lukket system, så gassen kan blive genanvendt (efter at gassen, på hensigtsmæssig vis, er blevet filtreret for forurening imellem brug)[37].
Medicinsk billeddannelse
Gamma udledningen fra radioisotopen 133Xe kan for eksempel bruges til at scanne (og derved danne billeder) af hjerte, lunger og hjernen ved hjælp af SPECT metoden. 133Xe er også blevet brugt til at måle blodgennemstrømning.[84][85][86]
Andet
Inden for atomkraft, bliver xenon brugt i bubblekamre,[87] i følere og indenfor andre områder hvor høj molmasse og inert natur er ønskværdige. Ved atomprøvesprængninger, dannes der de to radioaktive xenonisotoper 133Xe og 135Xe. Ved at spore disse to isotoper, kan man holde øje med om Traktaten om forbud mod sprængning af atomvåben i vores atmosfære, det ydre rum og under vandet (engelsk: Treaty banning Nuclear Weapon Tests In The Atmosphere, In Outer Space And Under Water) bliver overholdt af de lande som skrev under på den.[88] Isotoperne bliver desuden brugt til at detektere atomvåbensprængninger udført af øvrige lande, såsom Nordkorea.[88][89]

Flydende xenon bliver også brugt som et medie, når der ledes efter de hypotetiske WIMPs (Weakly Interacting Massive Particles). Når en WIMP kolliderer med en xenonkerne, skulle den rent teoretisk snuppe en elektron og danne primær scintillation. Ved at bruge xenon, skulle dette energiudbrud fremtræde under samme omstændigheder som partikler forårsaget ved for eksempel kosmisk stråling.[12] Med XENON-eksperimentet ved Laboratori Nazionali del Gran Sasso i Italien er dette ikke lykkedes endnu. Selvom der ikke er opdaget nogen WIMPs, har eksperimentet stadig indsnævret egenskaberne for mørkt stof, samt nogle andre fysiske modeller.[90] De nuværende detektorer hos Gran Sasso National Laboratory har vist følsomhed på højde med de bedste kryogendetektorer og deres følsomhed vil blive forøget i 2009.[91]
Xenon er det foretrukne brændstof i ion-motorer på rumskibe, på grund af dets lave ioniseringsenergi per atommasse og dens egenskab for at blive opbevaret på flydende form nær stuetemperatur (under højt tryk) og nemt omdannes igen til gas så den kan drive motoren. Fordi xenon ikke er kemisk reaktivt, gør det xenon til et miljøvenligt brændstof og mindre korroderende overfor ion-motoren i forhold til andre brændstoffer som for eksempel kviksølv og cæsium. Xenon blev først brugt som brændstof for ion-motorer i satelitter i 1970'erne.[92] Senere blev det brugt som drivmiddel i Europas SMART-1 rumskib[13] og for de 3 ion-motorer på NASAs Dawn Spacecraft.[93]
Kemisk bruges de perxenate forbindelser som oxidationsmidler i analytisk kemi. Xenon bruges også ofte i proteinkrystallografi. Ved høje tryk (5 til 50 atm) binder xenonatomer til hydrofobe hulrum i proteinet, hvilket ofte danner isomorfe tungatom-derivater af meget høj kvalitet. Disse kan bruges til at løse faseproblemet (fysik).[94][95]
Xenonforgiftning
Xenonforgiftning er et fænomen, hvor xenon dannes ved radioaktive henfald i kernereaktorer. Efter et stykke tid med et voksende mængde af xenon kan der være problemer med at starte reaktoren igen. Dette kendes som xenonforgiftning.
Man kan sikre en jævn udbrænding ved at kontrollere brændselsstængerne.
Forholdsregler
Xenon gas kan opbevares sikkert i lukkede glas eller metal beholdere ved standardbetingelser, men xenon vil med lethed opløse plastik og gummi og vil derfor ligeså stille forsvinde fra en beholder produceret af disse materialer.[96] Xenon i sig selv er ikke giftigt, dog opløses det i blodet og hører under den type af stoffer som trænger igennem blod-hjerne-barrieren og forårsager en mild kirurgisk narkose når den inhaleres sammen med større mængder ilt. Mange xenon forbindelser er meget eksplosive og giftige på grund af dets stærke oxidative egenskaber.[97] Lydens hastighed i xenon gas er 169m/s[98], det er langsommere end i atmosfærisk luft, hvilket betyder at når man inhalerer xenon, så vil man have et dybere stemmeleje i modsætning til hvis man inhalerer helium, hvor man får et højere stemmeleje. Ligesom helium, så tilfredsstiller xenon ikke kroppens behov for ilt og man kan risikere kvælning. På grund af dette, tillader mange universiteter ikke længere denne demonstration. Da xenon er en dyr gas, blev gassen sulfidhexaflourid brugt i stedet for, da den næsten har samme molekylær vægt (146 imod 131). Dog er der også risiko for kvælning ved brug af denne gas.[99] Det er muligt at trække vejret i disse tunge gasser såsom xenon og sulfidhexafluorid når de er blandet med 20 % ilt (igen skal det nævnes at xenon ved disse koncentrationer forventes at fremkalde bevidstløshed som lå man i almindelig narkose). Lungerne blander gasserne meget effektivt og meget hurtigt, så de tunge gasser bliver udåndet sammen med det overskydende ilt i lungerne og når ikke at ophobe sig i bunden af lungerne.[100] Der er dog en fare forbundet med at indånde tunge gasser i større mængder. Et eksempel er hvis en person går ind i en beholder med denne farveløs og lugtfrie gas, han kan uden at ane det indånde disse gasser og være i fare. Xenon anvendes dog sjældent i disse mængder, dog er faren der altid hvis en tank eller beholder bliver opbevaret på et dårligt ventileret sted.[101]
Se også
Referencer
- ^ Staff (2007). "Xenon". Columbia Electronic Encyclopedia (engelsk) (6 udgave). Columbia University Press. Hentet 2007-10-23.
- ^ a b Husted, Robert; Boorman, Mollie (15. december 2003). "Xenon". Los Alamos National Laboratory, Chemical Division. Arkiveret fra originalen 22. november 2010. Hentet 2007-09-26.
{{cite web}}: CS1-vedligeholdelse: Flere navne: authors list (link) - ^ Rabinovich, Viktor Abramovich; Vasserman, A. A.; Nedostup, V. I.; Veksler, L. S. (1988). Thermophysical properties of neon, argon, krypton, and xenon (engelsk) (English-language edition udgave). Washington, DC: Hemisphere Publishing Corp. ISBN 0-19-521833-7.
{{cite book}}:|edition=har ekstra tekst (hjælp)CS1-vedligeholdelse: Flere navne: authors list (link)—National Standard Reference Data Service of the USSR. Volume 10. - ^ a b Freemantel, Michael (25. august 2003). "Chemistry at its Most Beautiful" (PDF). Chemical & Engineering News. Hentet 2007-09-13.
- ^ a b Kaneoka, Ichiro (1998). "Xenon's Inside Story". Science. 280 (5365): 851-852. doi:10.1126/science.280.5365.851b. Hentet 2007-10-10.
- ^ Stacey, Weston M. (2007). Nuclear Reactor Physics. Wiley-VCH. s. 213. ISBN 3527406794.
- ^ a b c Burke, James (2003). Twin Tracks: The Unexpected Origins of the Modern World. Oxford University Press. s. 33. ISBN 0-7432-2619-4.
- ^ a b Mellor, David (2000). Sound Person's Guide to Video. Focal Press. s. p. 186. ISBN 0-240-51595-1.
{{cite book}}:|pages=har ekstra tekst (hjælp) - ^ a b Sanders, Robert D.; Ma, Daqing; Maze, Mervyn (2005). "Xenon: elemental anaesthesia in clinical practice". British Medical Bulletin (engelsk). 71 (1): 115-135. doi:10.1093/bmb/ldh034. ISSN 0007-1420. PMID 15728132.
{{cite journal}}:|access-date=kræver at|url=også er angivet (hjælp)CS1-vedligeholdelse: Flere navne: authors list (link) - ^ a b Basov, N. G.; Danilychev, V. A.; Popov, Yu. M. (1971). "Stimulated Emission in the Vacuum Ultraviolet Region". Soviet Journal of Quantum Electronics. 1 (1): 18-22. doi:10.1070/QE1971v001n01ABEH003011. Arkiveret fra originalen 16. maj 2020. Hentet 20. januar 2010.
{{cite journal}}: CS1-vedligeholdelse: Flere navne: authors list (link) - ^ a b Toyserkani, E.; Khajepour, A.; Corbin, S. (2004). Laser Cladding. CRC Press. s. 48. ISBN 0-8493-2172-7.
{{cite book}}: CS1-vedligeholdelse: Flere navne: authors list (link) - ^ a b Ball, Philip (1. maj 2002). "Xenon outs WIMPs". Nature. Hentet 2007-10-08.
- ^ a b Saccoccia, G.; del Amo, J. G.; Estublier, D. (31. august 2006). "Ion engine gets SMART-1 to the Moon". ESA. Hentet 2007-10-01.
{{cite news}}: CS1-vedligeholdelse: Flere navne: authors list (link) - ^ W. Ramsay and M. W. Travers (1898). "On the extraction from air of the companions of argon, and neon". Report of the Meeting of the British Association for the Advancement of Science: 828.
- ^ Gagnon, Steve. "It's Elemental - Xenon". Thomas Jefferson National Accelerator Facility. Hentet 2007-06-16.
- ^ Anonymous (1904). Daniel Coit Gilman, Harry Thurston Peck, Frank Moore Colby (red.). The New International Encyclopædia. Dodd, Mead and Company. s. p. 906.
{{cite book}}:|pages=har ekstra tekst (hjælp)CS1-vedligeholdelse: Flere navne: editors list (link) - ^ Staff (1991). The Merriam-Webster New Book of Word Histories. Merriam-Webster, Inc. s. p. 513. ISBN 0-87779-603-3.
{{cite book}}:|pages=har ekstra tekst (hjælp) - ^ Ramsay, William (1902). "An Attempt to Estimate the Relative Amounts of Krypton and of Xenon in Atmospheric Air". Proceedings of the Royal Society of London. 71: 421-426. doi:10.1098/rspl.1902.0121. Hentet 2007-10-02.
- ^ Anonymous. "History". Millisecond Cinematography. Arkiveret fra originalen 30. juni 2017. Hentet 2007-11-07.
- ^ Paschotta, Rüdiger (1. november 2007). "Lamp-pumped lasers". Encyclopedia of Laser Physics and Technology. RP Photonics. Hentet 2007-11-07.
- ^ Marx, Thomas; Schmidt, Michael; Schirmer, Uwe; Reinelt, Helmut (2000). "Xenon anesthesia" (PDF). Journal of the Royal Society of Medicine. 93: 513-517. Hentet 2007-10-02.
{{cite journal}}: CS1-vedligeholdelse: Flere navne: authors list (link) - ^ Clayton, Donald D. (1983). Principles of Stellar Evolution and Nucleosynthesis (2 udgave). University of Chicago Press. s. p. 75. ISBN 0-226-10953-4.
{{cite book}}:|pages=har ekstra tekst (hjælp) - ^ Bolt, B. A.; Packard, R. E.; Price, P. B. (2007). "John H. Reynolds, Physics: Berkeley". The University of California, Berkeley. Hentet 2007-10-01.
{{cite web}}: CS1-vedligeholdelse: Flere navne: authors list (link) - ^ Neil Bartlett and D. H. Lohmann (marts 1962). "Dioxygenyl hexafluoroplatinate (V), O2+[PtF6]−". Proceedings of the Chemical Society. London: Chemical Society (3): 115. doi:10.1039/PS9620000097.
- ^ a b Bartlett, N. (juni 1962). "Xenon hexafluoroplatinate (V) Xe+[PtF6]−". Proceedings of the Chemical Society. London: Chemical Society (6): 218. doi:10.1039/PS9620000197.
- ^ Graham, L.; Graudejus, O., Jha N.K., and Bartlett, N. (2000). "Concerning the nature of XePtF6". Coordination Chemistry Reviews. 197: 321-334. doi:10.1016/S0010-8545(99)00190-3.
{{cite journal}}: CS1-vedligeholdelse: Flere navne: authors list (link) - ^ p. 392, §11.4, Inorganic Chemistry, translated by Mary Eagleson and William Brewer, edited by Bernhard J. Aylett, San Diego: Academic Press, 2001, ISBN 0-12-352651-5; translation of Lehrbuch der Anorganischen Chemie, originally founded by A. F. Holleman, continued by Egon Wiberg, edited by Nils Wiberg, Berlin: de Gruyter, 1995, 34th edition, ISBN 3-11-012641-9.
- ^ Steel, Joanna (2007). "Biography of Neil Bartlett". College of Chemistry, University of California, Berkeley. Arkiveret fra originalen 12. juni 2008. Hentet 2007-10-25.
- ^ Bartlett, Neil (8. september 2003). "The Noble Gases". Chemical & Engineering News. American Chemical Society. 81 (36). Hentet 2007-10-01.
- ^ Khriachtchev, Leonid; Pettersson, Mika; Runeberg, Nino; Lundell, Jan; Räsänen, Markku (24. august 2000). "A stable argon compound". Nature. 406: 874-876. doi:10.1038/35022551. Hentet 2008-06-04.
{{cite journal}}: CS1-vedligeholdelse: Flere navne: authors list (link) - ^ Lynch, C. T.; Summitt, R.; Sliker, A. (1980). CRC Handbook of Materials Science. CRC Press. ISBN 0-87819-231-X.
{{cite book}}: CS1-vedligeholdelse: Flere navne: authors list (link) - ^ D. R. MacKenzie (20. september 1963). "Krypton Difluoride: Preparation and Handling". Science. 141 (3586): 1171. doi:10.1126/science.141.3586.1171. PMID 17751791.
- ^ Paul R. Fields, Lawrence Stein, and Moshe H. Zirin (1962). "Radon Fluoride". Journal of the American Chemical Society. 84 (21): 4164-4165. doi:10.1021/ja00880a048.
{{cite journal}}: CS1-vedligeholdelse: Flere navne: authors list (link) - ^ Hwang, Shuen-Cheng; Robert D. Lein, Daniel A. Morgan (2005). "Noble Gases". Kirk-Othmer Encyclopedia of Chemical Technology (5 udgave). Wiley. doi:10.1002/0471238961.0701190508230114.a01. ISBN 047148511X.
- ^ Kerry, Frank G. (2007). Industrial Gas Handbook: Gas Separation and Purification. CRC Press. s. pp. 101–103. ISBN 0-8493-9005-2.
{{cite book}}:|pages=har ekstra tekst (hjælp) - ^ "Xenon - Xe". CFC StarTec LLC. 10. august 1998. Arkiveret fra originalen 12. juni 2020. Hentet 2007-09-07.
- ^ a b Singh, Sanjay (15. maj 2005). "Xenon: A modern anaesthetic". Indian Express Newspapers Limited. Arkiveret fra originalen 13. august 2007. Hentet 2007-10-10.
- ^ a b Häussinger, Peter; Glatthaar, Reinhard; Rhode, Wilhelm; Kick, Helmut; Benkmann, Christian; Weber, Josef; Wunschel, Hans-Jörg; Stenke, Viktor; Leicht, Edith; Stenger, Hermann (2001). "Noble Gases". Ullmann's Encyclopedia of Industrial Chemistry (6. udgave). Wiley. doi:10.1002/14356007.a17_485. ISBN 3527201653.
{{cite book}}: CS1-vedligeholdelse: Flere navne: authors list (link) - ^ Williams, David R. (1. september 2004). "Mars Fact Sheet". NASA. Hentet 2007-10-10.
- ^ Schilling, James. "Why is the Martian atmosphere so thin and mainly carbon dioxide?". Mars Global Circulation Model Group. Arkiveret fra originalen 22. august 2011. Hentet 2007-10-10.
- ^ Zahnle, Kevin J. (1993). "Xenological constraints on the impact erosion of the early Martian atmosphere". Journal of Geophysical Research. 98 (E6): 10, 899-10, 913. doi:10.1029/92JE02941. Arkiveret fra originalen 19. april 2011. Hentet 2007-10-10.
- ^ Mahaffy, P. R.; Niemann, H. B.; Alpert, A.; Atreya, S. K.; Demick, J.; Donahue, T. M.; Harpold, D. N.; Owen, T. C. (2000). "Noble gas abundance and isotope ratios in the atmosphere of Jupiter from the Galileo Probe Mass Spectrometer". Journal of Geophysical Research. 105 (E6): 15061-15072. doi:10.1029/1999JE001224. Hentet 2007-10-01.
{{cite journal}}: CS1-vedligeholdelse: Flere navne: authors list (link) - ^ Owen, Tobias; Mahaffy, Paul; Niemann, H. B.; Atreya, Sushil; Donahue, Thomas; Bar-Nun, Akiva; de Pater, Imke (1999). "A low-temperature origin for the planetesimals that formed Jupiter". Nature. 402 (6759): 269-270. doi:10.1038/46232. Hentet 2007-02-04.
{{cite journal}}: CS1-vedligeholdelse: Flere navne: authors list (link) - ^ Arnett, David (1996). Supernovae and Nucleosynthesis. Princeton, New Jersey: Princeton University Press. ISBN 0-691-01147-8.
- ^ Sanloup, Chrystèle; et al. (2005). "Retention of Xenon in Quartz and Earth's Missing Xenon". Science. 310 (5751): 1174-1177. doi:10.1126/science.1119070. PMID 16293758.
{{cite journal}}:|access-date=kræver at|url=også er angivet (hjælp); Eksplicit brug af et al. i:|author=(hjælp) - ^ Clayton, Donald D. (1983). Principles of Stellar Evolution and Nucleosynthesis. University of Chicago Press. ISBN 0-226-10953-4.
- ^ Heymann, D.; Dziczkaniec, M. (19.-23. marts 1979). "Xenon from intermediate zones of supernovae". Proceedings 10th Lunar and Planetary Science Conference. Houston, Texas: Pergamon Press, Inc. s. pp. 1943-1959. Hentet 2007-10-02.
{{cite conference}}:|pages=har ekstra tekst (hjælp)CS1-vedligeholdelse: Dato-format (link) - ^ Williams, David R. (19. april 2007). "Earth Fact Sheet". NASA. Hentet 2007-10-04.
- ^ a b Aprile, Elena; Bolotnikov, Aleksey E.; Doke, Tadayoshi (2006). Noble Gas Detectors. Wiley-VCH. s. 8-9. ISBN 3527609636.
{{cite book}}: CS1-vedligeholdelse: Flere navne: authors list (link) - ^ Caldwell, W. A.; Nguyen, J.; Pfrommer, B.; Louie, S.; Jeanloz, R. (1997). "Structure, bonding and geochemistry of xenon at high pressures". Science. 277: 930-933. doi:10.1126/science.277.5328.930.
{{cite journal}}: CS1-vedligeholdelse: Flere navne: authors list (link) - ^ Bader, Richard F. W. "An Introduction to the Electronic Structure of Atoms and Molecules". McMaster University. Hentet 2007-09-27.
- ^ Talbot, John. "Spectra of Gas Discharges". Rheinisch-Westfälische Technische Hochschule Aachen. Arkiveret fra originalen 18. juli 2007. Hentet 2006-08-10.
- ^ Watts, William Marshall (1904). An Introduction to the Study of Spectrum Analysis. London: Longmans, Green, and co.
- ^ Status of ßß-decay in Xenon Arkiveret 27. september 2007 hos Wayback Machine, Roland Lüscher, accessed on line September 17, 2007.
- ^ Average (Recommended) Half-Life Values for Two-Neutrino Double-Beta Decay, A. S. Barabash, Czechoslovak Journal of Physics 52, #4 (April 2002), pp. 567–573.
- ^ Rajam, J. B. (1960). Atomic Physics (7 udgave). Delhi: S. Chand and Co. ISBN 81-219-1809-X.
- ^ a b "Xenon". Periodic Table Online. CRC Press. Arkiveret fra originalen 10. april 2007. Hentet 2007-10-08.
- ^ Moody, G. J. (1974). "A Decade of Xenon Chemistry". Journal of Chemical Education. 51: 628-630. Hentet 2007-10-16.
- ^ Harding, Charlie J.; Janes, Rob (2002). Elements of the P Block. Royal Society of Chemistry. ISBN 0-85404-690-9.
- ^ Gerber, R. B. (juni 2004). "Formation of novel rare-gas molecules in low-temperature matrices". Annual Review of Physical Chemistry. 55: 55-78. doi:10.1146/annurev.physchem.55.091602.094420.
- ^ Bartlett, 2003. Se paragrafen startende med Many recent findings.
- ^ Khriachtchev, Leonid; Isokoski, Karoliina; Cohen, Arik; Räsänen, Markku; Gerber, R. Benny (2008). "A Small Neutral Molecule with Two Noble-Gas Atoms: HXeOXeH". Journal of the American Chemical Society. 130 (19): 6114-6118. doi:10.1021/ja077835v. Hentet 2008-06-20.
{{cite journal}}: CS1-vedligeholdelse: Flere navne: authors list (link) - ^ Pettersson, Mika; Khriachtchev, Leonid; Lundell, Jan; Räsänen, Markku (1999). "A Chemical Compound Formed from Water and Xenon: HXeOH". Journal of the American Chemical Society. 121 (50): 11904-11905. doi:10.1021/ja9932784. Hentet 2007-10-10.
{{cite journal}}: CS1-vedligeholdelse: Flere navne: authors list (link) - ^ A molecular theory of general anesthesia, Linus Pauling, Science 134, #3471 (7. august 1961), pp. 15–21. Reprinted as pp. 1328–1334, Linus Pauling: Selected Scientific Papers, vol. 2, edited by Barclay Kamb et al. River Edge, New Jersey: World Scientific: 2001, ISBN 981-02-2940-2.
- ^ Ikeda, Tomoko; Mae, Shinji; Yamamuro, Osamu; Matsuo, Takasuke; Ikeda, Susumu; Ibberson, Richard M. (23. november 2000). "Distortion of Host Lattice in Clathrate Hydrate as a Function of Guest Molecule and Temperature". Journal of Physical Chemistry A. 104 (46): 10623-10630. doi:10.1021/jp001313j.
{{cite journal}}: CS1-vedligeholdelse: Flere navne: authors list (link) - ^ McKay, C. P.; Hand, K. P.; Doran, P. T.; Andersen, D. T.; Priscu, J. C. (2003). "Clathrate formation and the fate of noble and biologically useful gases in Lake Vostok, Antarctica". Geophysical Letters. 30 (13): 35. doi:10.1029/2003GL017490. Arkiveret fra originalen 19. april 2011. Hentet 2007-10-02.
{{cite journal}}: CS1-vedligeholdelse: Flere navne: authors list (link) - ^ Barrer, R. M.; Stuart, W. I. (1957). "Non-Stoichiometric Clathrate of Water". Proceedings of the Royal Society of London. 243: 172-189.
- ^ Frunzi, Michael; Cross, R. James; Saunders, Martin (2007). "Effect of Xenon on Fullerene Reactions". Journal of the American Chemical Society. 129: 13343. doi:10.1021/ja075568n.
{{cite journal}}: CS1-vedligeholdelse: Flere navne: authors list (link) - ^ Staff (2007). "Xenon Applications". Praxair Technology. Arkiveret fra originalen 22. marts 2013. Hentet 2007-10-04.
- ^ Baltás, E.; Csoma, Z.; Bodai, L.; Ignácz, F.; Dobozy, A.; Kemény, L. (2003). "A xenon-iodine electric discharge bactericidal lamp". Technical Physics Letters. 29 (10): 871-872. doi:10.1134/1.1623874.
{{cite journal}}: CS1-vedligeholdelse: Flere navne: authors list (link) - ^ Skeldon, M.D.; Saager, R.; Okishev, A.; Seka, W. (1997). "Thermal distortions in laser-diode- and flash-lamp-pumped Nd:YLF laser rods" (PDF). LLE Review. 71: 137-144. Arkiveret fra originalen (PDF) 16. oktober 2003. Hentet 2007-02-04.
{{cite journal}}: CS1-vedligeholdelse: Flere navne: authors list (link) - ^ Anonymous. "The plasma behind the plasma TV screen". Plasma TV Science. Arkiveret fra originalen 15. oktober 2007. Hentet 2007-10-14.
- ^ Marin, Rick (21. marts 2001). "Plasma TV: That New Object Of Desire". The New York Times. Hentet 2009-04-03.
- ^ Waymouth, John (1971). Electric Discharge Lamps. Cambridge, MA: The M.I.T. Press. ISBN 0262230488.
- ^ Patel, C. K. N.; Bennett Jr., W. R.; Faust, W. L.; McFarlane, R. A. (1. august 1962). "Infrared spectroscopy using stimulated emission techniques". Physical Review Letters. 9 (3): 102-104. doi:10.1103/PhysRevLett.9.102.
{{cite journal}}: CS1-vedligeholdelse: Flere navne: authors list (link) - ^ Patel, C. K. N.; Faust, W. L.; McFarlane, R. A. (1. december 1962). "High gain gaseous (Xe-He) optical masers". Applied Physics Letters. 1 (4): 84-85. doi:10.1063/1.1753707.
{{cite journal}}: CS1-vedligeholdelse: Flere navne: authors list (link) - ^ Bennett, Jr., W. R. (1962). "Gaseous optical masers". Applied Optics Supplement. 1: 24-61.
- ^ "Laser Output". University of Waterloo. Arkiveret fra originalen 8. april 2009. Hentet 2007-10-07.
- ^ Baltás, E.; Csoma, Z.; Bodai, L.; Ignácz, F.; Dobozy, A.; Kemény, L. (juli 2006). "Treatment of atopic dermatitis with the xenon chloride excimer laser". Journal of the European Academy of Dermatology and Venereology. 20 (6): 657-660. doi:10.1111/j.1468-3083.2006.01495.x.
{{cite journal}}: CS1-vedligeholdelse: Flere navne: authors list (link) - ^ Tonner, P. H. (2006). "Xenon: one small step for anaesthesia…? (editorial review)". Current Opinion in Anaesthesiology. 19 (4): 382-384. doi:10.1097/01.aco.0000236136.85356.13.
- ^ Franks, John J.; Horn, Jean-Louis; Janicki, Piotr K.; Singh, Gurkeerat (1995). "Halothane, Isoflurane, Xenon, and Nitrous Oxide Inhibit Calcium ATPase Pump Activity in Rat Brain Synaptic Plasma Membranes". Anesthesiology. 82 (1): 108-117. doi:10.1097/00000542-199501000-00015.
{{cite journal}}: CS1-vedligeholdelse: Flere navne: authors list (link) - ^ Lopez, Maria M.; Kosk-Kosicka, Danuta (1995). "How do volatile anesthetics inhibit Ca2+-ATPases?". Journal of Biological Chemistry. 270 (47): 28239-28245. doi:10.1074/jbc.270.47.28239. PMID 7499320.
- ^ Heimburg, T.; Jackson A. D. (2007). "The thermodynamics of general anesthesia". Biophysical Journal. 92 (9): 3159-65. doi:10.1529/biophysj.106.099754. PMID 17293400.
- ^ Van Der Wall, Ernst (1992). What's New in Cardiac Imaging?: SPECT, PET, and MRI. Springer. ISBN 0792316150.
- ^ Frank, John (1999). "Introduction to imaging: The chest". Student BMJ. 12: 1-44. Hentet 2008-06-04.
- ^ Chandak, Puneet K. (20. juli 1995). "Brain SPECT: Xenon-133". Brigham RAD. Arkiveret fra originalen 4. januar 2012. Hentet 2008-06-04.
- ^ Galison, Peter Louis (1997). Image and Logic: A Material Culture of Microphysics. University of Chicago Press. s. 339. ISBN 0226279170.
- ^ a b Fontaine, J.-P.; Pointurier, F.; Blanchard, X.; Taffary, T. (2004). "Atmospheric xenon radioactive isotope monitoring". Journal of Environmental Radioactivity. 72 (1-2, ): 129-135. doi:10.1016/S0265-931X(03)00194-2.
{{cite journal}}: CS1-vedligeholdelse: Ekstra punktum (link) CS1-vedligeholdelse: Flere navne: authors list (link) - ^ Garwin, Richard L.; von Hippel Frank N. (november 2006). "A Technical Analysis: Deconstructing North Korea's October 9 Nuclear Test". Arms Control Today. Arms Control Association. 38 (9). Hentet 2009-03-26.
{{cite journal}}: CS1-vedligeholdelse: Flere navne: authors list (link) - ^ Schumann, Marc (10. oktober 2007). "XENON announced new best limits on Dark Matter". Rice University. Arkiveret fra originalen 12. oktober 2007. Hentet 2007-10-08.
- ^ Boyd, Jade (23. august 2007). "Rice physicists go deep for 'dark matter'". Hubble News Desk. Hentet 2007-10-08.
- ^ Zona, Kathleen (17. marts 2006). "Innovative Engines: Glenn Ion Propulsion Research Tames the Challenges of 21st century Space Travel". NASA. Arkiveret fra originalen 20. juni 2015. Hentet 2007-10-04.
- ^ "Dawn Launch: Mission to Vesta and Ceres" (PDF). NASA. Hentet 2007-10-01.
- ^ Staff (21. december 2004). "Protein Crystallography: Xenon and Krypton Derivatives for Phasing". PX. Arkiveret fra originalen 16. marts 2005. Hentet 2007-10-01.
- ^ Drenth, Jan; Mesters, Jeroen (2007). "The Solution of the Phase Problem by the Isomorphous Replacement Method". Principles of Protein X-Ray Crystallography (3 udgave). New York: Springer. s. 123-171. doi:10.1007/0-387-33746-6_7. ISBN 978-0-387-33334-2.
- ^ LeBlanc, Adrian D.; Johnson, Philip C. (1971). "The handling of xenon-133 in clinical studies". Physics in Medicine and Biology. 16 (1): 105-109. doi:10.1088/0031-9155/16/1/310. PMID 5579743.
- ^ Finkel, A. J.; Katz, J. J.; Miller, C. E. (1. april 1968). "Metabolic and toxicological effects of water-soluble xenon compounds are studied". NASA. Hentet 2007-10-04.
{{cite web}}: CS1-vedligeholdelse: Flere navne: authors list (link) - ^ 169.44 m/s in xenon (at 0 °C and 107 KPa), compared to 344 m/s in air. See:Vacek, V.; Hallewell, G.; Lindsay, S. (2001). "Velocity of sound measurements in gaseous per-fluorocarbons and their mixtures". Fluid Phase Equilibria. 185: 305-314. doi:10.1016/S0378-3812(01)00479-4.
{{cite journal}}: CS1-vedligeholdelse: Flere navne: authors list (link) - ^ Spangler, Steve (2007). "Anti-Helium - Sulfur Hexafluoride". Steve Spangler Science. Arkiveret fra originalen 29. september 2007. Hentet 2007-10-04.
- ^ Yamaguchi, K.; Soejima, K.; Koda, E.; Sugiyama, N (2001). "Inhaling Gas With Different CT Densities Allows Detection of Abnormalities in the Lung Periphery of Patients With Smoking-Induced COPD". Chest Journal. 51 (6): 1907-1916. doi:10.1378/chest.120.6.1907. PMID 11742921.
{{cite journal}}: CS1-vedligeholdelse: Flere navne: authors list (link) - ^ Staff (1. august 2007). "Cryogenic and Oxygen Deficiency Hazard Safety". Stanford Linear Accelerator Center. Arkiveret fra originalen 9. juni 2007. Hentet 2007-10-10.
Eksterne henvisninger
Medier brugt på denne side
(c) Peo at the Danish language Wikipedia, CC BY-SA 3.0
Denne tegning forestiller elektronkonfigurationen i et xenonatom: Den store kugle i midten forestiller atomkernen, og de små kugler er elektronerne. Bogstaverne på elektron-kuglerne angiver hvilken orbital de tilhører. Den blå farve markerer at xenon hører til ædelgasserne.
(c) Peo at the Danish language Wikipedia, CC BY-SA 3.0
Denne tegning forestiller elektronkonfigurationen i et xenonatom: Den store kugle i midten forestiller atomkernen, og de små kugler er elektronerne. Bogstaverne på elektron-kuglerne angiver hvilken orbital de tilhører. Den blå farve markerer at xenon hører til ædelgasserne.
Image of a xenon ion engine prototype.
On Oct. 2, 1962, Argonne announced the creation of xenon tetrafluoride, the first simple compound of xenon, a noble gas widely thought to be chemically inert. The creation opened a new era for the study of chemical bonds.
Structure of Xenon tetraflouride, one of the first noble gas compounds to be discovered.
Forfatter/Opretter: Alchemist-hp (talk) (www.pse-mendelejew.de), Licens: FAL
Spectrum = gas discharge tube: the noble gas: xenon Xe. Used with 1,8kV, 18mA, 35kHz. ≈8" length.
(c) Atlant, CC BY 2.5
Close-up of a 15KW Xenon short-arc lamp. See also end view.
(c) Pslawinski, CC BY-SA 2.5
Image of a xenon filled discharge tube shaped like the element’s atomic symbol.










