Voltasøjle
 Der er for få eller ingen kildehenvisninger i denne artikel, hvilket er et problem. Du kan hjælpe ved at angive troværdige kilder til de påstande, som fremføres i artiklen.
Der er for få eller ingen kildehenvisninger i denne artikel, hvilket er et problem. Du kan hjælpe ved at angive troværdige kilder til de påstande, som fremføres i artiklen.
En voltasøjle er den tidligste forløber for vore dages elektriske batteri: Den blev opfundet af den italienske fysiker Alessandro Volta, som offentliggjorde sine opdagelser i en afhandling til Royal Society den 20. marts 1800.
Sådan virker voltasøjlen
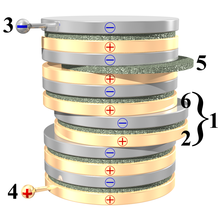
Tegningen til højre viser de væsentligste dele af en voltasøjle med seks celler: Hver enkelt celle (1) består typisk af en kobberskive (2) og en zinkskive (6), med en skive (5) af pap eller læder vædet i en svagt sur eller basisk opløsning lagt imellem metalskiverne. Andre metaller kan også bruges, f.eks. sølv og tin, men med de viste metaller giver hver enkelt celle en elektrisk spænding på omkring 1,1 volt. Ved at stable dem som her (bemærk at kobber-"siden" af den ene celle ligger imod zink-"siden" af den næste) opnår man en serieforbindelse, så man ved den negative og positive terminal (3 og 4) kan "tappe" summen af de enkelte cellers spænding.
Der hvor opløsningen i papskiverne rører ved en zinkskive opløses en smule af zinket: Nogle af zink-atomerne afleverer to elektroner til den tilbageværende del af zinkskiven, og bliver selv til positivt ladede zink-ioner: Modsat "frit", metallisk zink kan disse ioner vandre igennem opløsningen i papskiven, og nå frem til kobberskiven. Da ionerne "efterlod" to elektroner til zinkskiven og ankommer positivt ladede til kobberskiven, opstår der en elektrisk spænding mellem de to metalskiver, og hvis man forbinder søjlen til et elektrisk kredsløb, får de efterladte elektroner muligheden for at nå frem til kobberskiven og "udligne" ladningsforskellen.
Historie
Omkring 1786 havde Voltas landsmand, anatomen Luigi Galvani, opdaget at man kan få dissekerede ben fra frøer til at bevæge sig ved at berøre dem med to redskaber lavet af forskellige metaller. På Galvanis tid havde man en teori om, at der krævedes en særlig "livskraft" for at danne organiske kemiske forbindelser, så Galvani var helt overbevist om at det fænomen han havde opdaget, skyldtes såkaldt "dyrisk elektricitet", som ifølge ham var knyttet til selve frø-benet snarere end til metalredskaberne.
Volta var uenig med Galvani, og de to diskuterede ivrigt emnet indtil Galvanis død i 1798. Volta havde allerede i 1790 påvist den såkaldte "galvanisme"; at elektricitet kunne skabes blot ved at to metaller rørte hinanden. Volta mente at forklaringen netop lå i at der skulle bruges to forskellige metaller i Galvanis forsøg, og ved forsøg med metalstænger i vinkarafler med opløsninger fandt han ud af at det mest "effektive" par af metaller er sølv og zink. Senere forbedrede han systemet ved at bruge metal i flade skiver i stedet for stænger, erstatte karaflerne med papskiver vædet opløsningen, og serieforbinde cellerne ved at stable dem. Hvis en enkelt voltasøjle blev så tung at vægten pressede opløsningen ud af de nederste celler, kunne man også serieforbinde flere mindre søjler.
Kontaktspænding?
Voltasøjlen modbeviste endegyldigt Galvanis teori om dyrisk elektricitet, så man måtte finde en anden forklaring på hvordan frø-ben og vådt pap kunne skabe elektrisk strøm sammen med de to metaller. Volta anstillede selv en teori om såkaldt kontaktspænding; et fænomen der angiveligt skulle finde sted der hvor to forskellige metaller berører hinanden direkte — denne teori er i dag forkastet til fordel for den elektrokemiske forklaring.
Elektricitetens muligheder
Med voltasøjlen havde videnskaben og verden generelt fået sin første kilde til kontinuerlig elektrisk strøm: Det åbnede "døren" for elektricitetens "tidsalder", og for en helt ny kemisk disciplin; elektrokemi. Sir Humphry Davy brugte voltasøjlen til elektrolyse-eksperimenter hvor han som den første isolerede metallerne natrium, kalium, barium, strontium, calcium og magnesium. Den 20. marts 1800; den dag Volta offentliggjorde sin opfindelse, betragtes som elektrokemiens "fødselsdag", og SI-enheden for elektrisk spænding, volt, er opkaldt efter ham.
Eksterne henvisninger
|
Medier brugt på denne side
Forfatter/Opretter: No machine-readable author provided. Peo~commonswiki assumed (based on copyright claims)., Licens: CC BY-SA 3.0
This illustration shows the basic components in a voltaic pile; Metal and "soaked" disks, along with common terminals to the entire pile, and annotations. The numbers in the picture refers to:
- One element
- Copper disc
- Negative terminal for the entire pile
- Positive terminal for the entire pile
- Soaked disc of cardboard or leather, with acidic og alkaline solution.
- Zinc disc