Tuberkulose
| Tuberculosis Klassifikation | |
|---|---|
 Røntgenbillede af patient med tuberkulose. | |
| Information | |
| Navn | Tuberculosis |
| Medicinsk fagområde | lungemedicin, infektionsmedicin |
| Genetisk association | IL2RB, SPON1, VWA8, ZFPM2, C2CD2, DYNC2H1, NAA60, DCUN1D5, DSCAM |
| SKS | DA15-A19 |
| ICD-10 | A15-A19 |
| ICD-9 | – 018 010 – 018 |
| OMIM | 607948 |
| DiseasesDB | 8515 |
| MedlinePlus | 000077 |
| eMedicine | med/2324 emerg/618 radio/411 |
| Patientplus | tuberculosis-pro |
| MeSH | D014376 |
| Information med symbolet | |
Tuberkulose, MTB eller TB (en forkortelse af tuberkelbakterien) er en udbredt smitsom sygdom ofte med dødelig udgang. Sygdommen forårsages af forskellige stammer fra mykobakterie-komplekset, som regel Mycobacterium tuberculosis.[1] Tuberkulose forekommer typisk i lungerne, men kan også angribe andre organer. Tuberkulose smitter gennem luften, når personer med en aktiv TB-infektion hoster, nyser eller overfører spyt gennem luften.[2] De fleste infektioner er asymptomatiske og latente. Men hos én ud af ti udvikler en latent infektion sig til aktiv sygdom. Ubehandlet tuberkulose dræber over 50% af de smittede.
Klassiske symptomer på aktiv TB er kronisk hoste med blodigt opspyt, feber, nattesved og vægttab. Tidligere kaldte man TB for "tæring", fordi patienterne tabte vægt. Infektion i andre organer giver mange forskellige symptomer. Diagnose af aktiv TB kræver en røntgenundersøgelse (som regel af brystkassen) samt mikroskopisk undersøgelse og dyrkning af kropsvæsker. Latent TB kan diagnosticeres med en tuberkulinprøve og blodprøver. TB er svær at behandle, og man er nødt til at tage antibiotika i en længere periode. Sociale kontakter screenes og behandles, hvis det er nødvendigt. Antibiotikaresistens er et voksende problem i behandlingen af infektioner med multiresistente tuberkulosebakterier (MDR-TB). TB forebygges ved at screene folk for sygdommen og vaccinere med calmette-vaccine.
Eksperter mener, at en tredjedel af verdens befolkning er smittet med M. tuberculosis,[3] og der kommer nye tilfælde til hvert sekund.[3] I 2007 var der ca. 13,7 millioner aktive, kroniske tilfælde på verdensplan.[4] I 2010 kom der ca. 8.8 millioner nye tilfælde, og 1.5 million døde som følge af sygdommen, mest i ulande.[5] Det totale antal tilfælde af tuberkulose er dalet siden 2006, og antallet af nye tilfælde har været i tilbagegang siden 2002.[5] Tuberkulose er ikke jævnt fordelt i verden. Ca. 80% af befolkningen i mange asiatiske og afrikanske lande tester positiv ved tuberkulinprøver, mens tallet i USA kun er 5-10%.[1] Der er flere tilfælde af TB i ulandene, da folk der typisk har et svækket immunforsvar. Når disse mennesker får tuberkulose, er det typisk, fordi de er smittet med HIV og udvikler AIDS.[6]
Tegn og symptomer
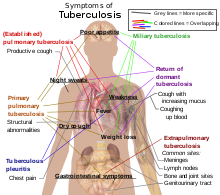
Mellem fem og ti procent af de TB-ramte, der ikke har HIV, udvikler den aktive sygdom på et tidspunkt i livet.[8] Dette tal er 30% for HIV-smittede TB-patienter.[8] Tuberkulose kan forekomme overalt i kroppen, men det ses hyppigst i lungerne (lungetuberkulose eller pulmonal tuberkulose).[9] Tuberkulose uden for lungerne kaldes ekstrapulmonal tuberkulose, som godt kan forekomme sammen med pulmonal tuberkulose.[9] Almindelige tegn og symptomer omfatter feber, kulderystelser, nattesved, tab af appetit, vægttab og træthed.[9] Patienten kan udvikle såkaldte trommestikfingre i udpræget grad.[8]
Pulmonal
Hvis en tuberkuloseinfektion bliver aktiv, angriber den i 90% af tilfældene lungerne.[6][10] Symptomerne kan omfatte brystsmerter og længerevarende produktiv hoste. Ca. 25% af de ramte har et asymptomatisk sygdomsforløb.[6] Nogle gange ses hoste med blodigt opspyt i mindre grad. I sjældne tilfælde kan infektionen nå lungepulsåren, så der opstår en massiv blødning, der kaldes Rasmussens aneurisme. Tuberkulose kan blive kronisk og give udbredt ardannelse i de øvre lungelapper. Det er som regel de øvre dele af lungerne, der angribes.[9] Grunden til dette er ikke helt klarlagt.[1] Måske angribes de øvre lunger mest på grund af den bedre luftgennemstrømning eller dårligt lymfeafløb.[1][9]
Ekstrapulmonal
I 15–20% af de aktive tilfælde spreder infektionen sig ud fra åndedrætsorganerne og giver andre typer tuberkulose.[11] Når TB forekommer uden for åndedrætsorganerne, kaldes det ekstrapulmonal tuberkulose.[12] Ekstrapulmonal TB forekommer hyppigere hos personer, der er i immunundertrykkende behandling, immunsuppression og hos små børn. Ekstrapulmonal TB forekommer hos over 50% af de HIV-smittede.[12] Ekstrapulmonale infektioner findes især i lungehinden (tuberkuløs lungehindebetændelse), centralnervesystemet (tuberkuløs meningitis) og i lymfesystemet (skrofulose på halsen). Ekstrapulmonal TB ses også i det urogenitale system (urogenital tuberkulose), i knogler og led (Potts sygdom i rygsøjlen) samt andre steder. Hvis TB når knoglerne, kaldes det knogletuberkulose,[13] som er en type af knoglemarvsbetændelse.[1] En farligere og mere udbredt type TB er miliærtuberkulose.[9] Miliærtuberkulose udgør ca. 10% af de ekstrapulmonale tilfælde.[14]
Årsager
Mykobakterier

Den største årsag til TB er Mycobacterium tuberculosis, en lille aerob bakterie, der ikke kan bevæge sig.[9] Mange af denne sygdomsfremkaldende bakteries unikke kliniske kendetegn skyldes dens høje indhold af lipider.[15] Cellen deler sig hver 16. –20. time. Det er meget langsomt sammenlignet med andre bakterier, der normalt deler sig på mindre end en time.[16] Mykobakterier har et lipidlag om cellemembranen.[17] Ved en gramfarvning vil MTB kun vise sig meget lidt eller slet ikke "grampositive", fordi cellevæggen har et højt indhold af lipider og mykolsyre.[18] MTB kan modstå svage bakteriedræbende midler og kan overleve som endospore (dvs. i dehydreret tilstand) i flere uger. I naturen kan bakterien kun vokse i en værtsorganisme, men M. tuberculosis kan dyrkes i laboratoriet.[19]
Ved hjælp af histologisk farvning i prøver af ophostet slim (også kaldet opspyt) kan forskere identificere MTB i et almindeligt mikroskop. Nogle af M. tuberculosis-pletterne overlever behandling med en syreopløsning. Den klassificeres derfor som en syrefast bakterie.[1][18] De to mest almindelige farvningsteknikker ved syrefaste bakterier er Ziehl–Neelsen-farvning, som farver syrefaste bakterier klart røde, så de kan ses tydeligt på en blå baggrund,[20] og auramin-rhodamin-farvning efterfulgt af fluorescerensmikroskopi.[21]
M. tuberculosis-komplekset omfatter fire andre mykobakterier, der giver tuberkulose: “M. bovis,” “M. africanum,” “M. canetti,” og “M. microti".[22] “M. africanum” er ikke så udbredt, men den er årsag til mange tuberkulosetilfælde i Afrika.[23][24] “M. bovis” var tidligere en udbredt årsag til tuberkulose, men efter indførelsen af pasteuriseret mælk er denne mykobakterie næsten udryddet i i-landene.[1][25] “M. canetti” er sjælden og synes kun at findes på Afrikas Horn, selvom der har været nogle få tilfælde blandt afrikanske emigranter.[26][27] “M. microti” er også sjælden og ses mest hos mennesker med svækket immunforsvar, men den kan være mere udbredt, end vi tror.[28]
Andre kendte patogene mykobakterier er “M. leprae,” “M. avium,” og “M. kansasii.” De sidste to er klassificeret som "ikke tuberkuløse mykobakterier" på engelsk kaldet "nontubercolous mycobacteria" (NTM). Disse bakterier giver ikke TB eller spedalskhed, men de giver andre lungesygdomme, der minder om TB.[29]
Risikofaktorer
Der er flere faktorer, der gør folk mere modtagelige for TB-infektioner. Den største faktor på verdensplan er HIV; 13% af alle, der får TB, har også HIV-virus.[5] Det er et udbredt problem i Afrika syd for Sahara, hvor mange har HIV.[30][31] Tuberkulose hænger tæt sammen med stor befolkningstæthed og dårlig ernæring. Denne forbindelse gør TB til en af de største fattigdomssygdomme.[6] Følgende grupper har en høj risiko for at få TB: folk, der tager ulovlige stoffer; folk, der bor eller arbejder, hvor udsatte grupper mødes (såsom fængsler og hjemløseherberger); folk, der er fattige og ikke har adgang til korrekt lægebehandling; udsatte etniske minoriteter; børn, der kommer i tæt kontakt med udsatte grupper; og det sundhedspersonale, der hjælper disse mennesker.[32] Kronisk lungesygdom er endnu en risikofaktor. Stenlunger øger risikoen ca. 30 gange.[33] Folk, der ryger cigaretter, har en næsten dobbelt så høj risiko for at få TB som ikke-rygere.[34] Andre tilstande kan også øge risikoen for at udvikle tuberkulose, blandt andet alkoholisme[6] og diabetes mellitus (tre gange så høj risiko).[35] Visse lægemidler, såsom kortikosteroider og infliximab (et monoklonalt antistof mod TNF-α) udgør en stadig større risikofaktor især i i-landene.[6] Man kan også være genetisk disponeret,[36] men videnskaben ved endnu ikke, hvor stor den risiko er.[6]
Mekanisme

Overførsel
Når personer med aktiv pulmonal TB hoster, nyser, taler, synger eller spytter, spreder de smittebærende luftbårne dråber med en diameter mellem 0,5 og 5 µm. Et enkelt nys kan sprede op til 40.000 dråber.[37] Hver dråbe kan overføre sygdommen, fordi der skal en meget lille mængde til, før man bliver smittet med tuberkulose. En person, der indånder under 10 bakterier, kan blive smittet.[38]
De, der kommer i kontakt med patienter med TB længe, tit eller på tæt hold, har højere risiko for at blive smittet. Smitteraten er ca. 22%.[39] En person med aktiv men ubehandlet tuberkulose kan smitte 10-15 (eller flere) andre om året.[3] Normalt er det kun personer med aktiv TB, der overfører sygdommen. Det menes ikke, at patienter med en latent infektion smitter.[1] Sandsynligheden for, at sygdommen overføres fra en person til en anden, afhænger af flere faktorer. De omfatter antallet af smittebærende dråber, bæreren spreder; hvor effektivt omgivelserne er ventileret; hvor længe personen udsættes for risiko; hvor virulent M. tuberculosis stammen er; og hvor godt et immunforsvar den usmittede person har.[40] For at forebygge en voldsom spredning mellem mennesker, bør personer med aktiv TB isoleres og straks behandles med lægemidler mod TB. Efter cirka to ugers effektiv behandling er personer med ikkeresistente aktive infektioner som regel ikke smittefarlige mere.[39] Det tager typisk tre til fire uger, før infektionen er voldsom nok til, at personen kan overføre sygdommen til andre.[41]
Patogenese
Cirka 90% af dem, der er smittet med M. tuberculosis har asymptomatiske, latente TB-infektioner.[42] Disse personer har kun 10% risiko for, at den latente infektion bryder ud til en aktiv tuberkulose i løbet af livet.[43] For personer med HIV er risikoen næsten 10% om året.[43] Hvis man ikke modtager effektiv behandling, er dødeligheden for aktiv TB op til 66%.[3]
TB-infektionen begynder, når mykobakterierne når lungealveolerne, hvor de optages og deler sig i endosomerne i de alveolære makrofager.[1][44] Det primære sted, infektionen sætter sig i lungen, kaldes "den tuberkuløse primærinfektion" eller af og til Ghons fokus. Det findes enten i den øvre del af den nedre lap eller den nedre del af den øvre lap.[1] Tuberkulose i lungerne kan også spredes til lungerne med blodet. Så sidder infektionen typisk øverst i lungen.[45] Denne hæmatogene transmission kan også sprede infektionen til fjernere steder, såsom de perifere lymfeknuder, nyrerne, hjernen og knoglerne.[1][46] Tuberkulose kan angribe alle dele af kroppen, men af en eller anden grund angriber den sjældent hjerte, skeletmuskulatur, bugspytkirtel, eller skjoldbruskkirtel.[47]
Tuberkulose klassificeres som en granulomatøs betændelsessygdom. Makrofager, T-lymfocytter, B-lymfocytter og fibroblaster er nogle af de celler, der samler sig og danner granulomer. Lymfocytter omgiver de inficerede makrofager. Granulomerne forhindrer spredningen af mykobakterierne og danner et miljø, hvor immunsystemets celler kan samarbejde. De bakterier, der er inde i et granulom, kan ligge i dvale, hvilket giver en latent infektion. Endnu en egenskab ved granulomerne er, at de udvikler abnormal celledød (nekrose) midt i tuberklerne. Med det blotte øje minder nekrosen om blød, hvid ost, og den kaldes derfor kaseøs (osteagtig) nekrose.[48]
TB-bakterier kan nå ind i blodårerne fra et område med skadet væv. De kan sprede sig i hele kroppen og danne mere end et infektionsfokus, der kan ses som små hvide tuberkler i vævet.[49] Denne alvorlige type TB kaldes miliærtuberkulose, og den er mest udbredt blandt små børn og HIV-patienter.[50] Personer med denne disseminerede (udbredte) TB har en højere risiko for at dø, selvom de modtager behandling (cirka 30%).[14][51]
Hos mange patienter aftager og tiltager infektionen. Ødelæggelse af væv og nekrose afbalanceres tit af, at vævet kommer sig og af fibrose.[48] Ødelagt væv erstattes af arvæv og udhulninger udfyldes af kaseøst, nekrotisk materiale. Mens sygdommen er aktiv, forbindes nogle af udhulningerne med luftvejene bronkierne, og så bliver noget af materialet hostet op. Materialet indeholder levende bakterier, der kan sprede infektionen. Hvis man behandles med de rette antibiotika, slås bakterierne ihjel, og vævet kan hele. Når sygdommen er kureret, erstattes de angrebne områder af arvæv.[48]
Diagnose
Aktiv tuberkulose
Det er vanskeligt at diagnosticere aktiv tuberkulose udelukkende ud fra tegn og symptomer.[52] Det er også vanskeligt at diagnosticere sygdommen hos personer, der er i immunundertrykkende behandling, immunsuppression.[53] Men personer med tegn på lungesygdom eller konstitutionelle symptomer i over to uger kan have TB.[53] Et røntgenbillede af brystkassen og flere opdyrkninger af opspyt for syrefaste bakterier indgår normalt i den første udredning.[53] Interferon-gamma frigørelsesanalyser (IGRA'er) og tuberkulinprøver kan ikke bruges i den tredje verden.[54][55] IGRA'erne duer heller ikke til personer med HIV.[56][55]
En definitiv diagnose af TB foreligger, når der findes “M. tuberculosis” i en klinisk prøve af fx opspyt, pus eller en vævsprøve. Dog kan den vanskelige dyrkningsproces af denne langsomtvoksende organisme tage mellem to og seks uger for blod og opspyt.[57] Derfor indledes behandlingen tit, før prøverne bekræftes.[58]
Nukleinsyreamplifikationstestning og adenosindeaminase-testning kan hurtigt diagnosticere TB.[52] Dog anbefales disse prøver ikke rent rutinemæssigt, fordi de sjældent ændrer på behandlingen.[58] Blodprøver for antistoffer er ikke specifikke eller sensitive, så de anbefales ikke.[59]
Latent tuberkulose

En Mantoux tuberkulinprøve bruges tit til at screene folk, der har høj risiko for at få TB.[53] Personer, der tidligere er blevet immuniseret, kan give falsk positivt resultat.[60] Andre grupper, der kan give et falsk positivt resultat, er personer med sarkoidose, Hodgkins lymfom og underernæring. Men endnu vigtigere er det, at personer med aktiv tuberkulose kan givet et falsk negativt resultat.[1] Interferon-gamma frigørelsesanalyser (IGRA'er) af en blodprøve anbefales til folk, der har en positiv tuberkulinprøve.[58] IGRA'er påvirkes ikke af immunisering eller af de fleste mykobakterier i miljøet, så de giver færre falsk positive resultater.[61] De reagerer dog på “M. szulgai,” “M. marinum” og “M. kansasii".[62] IGRA'er kan øge sensitiviteten, når de bruges som supplement til tuberkulinprøven. Men IGRA'er kan være mindre sensitive end tuberkulinprøven, hvis de anvendes alene.[63]
Forebyggelse
Dette afsnit er forældet |
Forebyggelsesarbejdet mod tuberkulose består i vaccination af små børn samt udredning og korrekt behandling af aktive tilfælde.[6] Verdenssundhedsorganisationen (WHO) har opnået rimelige resultater med forbedrede behandlingsplaner. Der er sket et mindre fald i sygdomstilfældene.[6]
Vacciner
I skrivende stund (2011), er den eneste vaccine Calmette-vaccinen. Calmette-vaccinen er effektiv mod dissemineret (miliær) TB i barndommen, men den er ikke en sikker beskyttelse mod lungetuberkulose.[64] Ikke desto mindre er det den mest udbredte vaccine på verdensplan, da over 90% af alle børn er blevet vaccineret.[6] Dog falder immuniteten efter cirka ti år.[6] Tuberkulose er stort set ukendt i det meste af Canada, Storbritannien og USA, så i de lande får kun personer, der har en høj risiko, en Calmette-vaccine.[65][66][67] En grund til at undgå vaccinen er, at den giver falsk positive resultater af tuberkulinprøver, så prøven kan ikke bruges til at screene for sygdommen.[67] Nye vacciner er under udvikling.[6]
Danske forskere fra Seruminstituttet i København publicerede i december 2013, at de har udviklet en ny vaccine, der lærer immunforsvaret at genkende nogle essentielle proteiner i tuberkulose-bakterien. Vaccinen gør, at bakterien har langt sværere ved at undslippe kroppens naturlige forsvar. Vaccinen er indtil videre kun afprøvet på mus, men den har vist lovende tendenser.[68][69] I 2014 blev forberedt forsøg på mennesker i både Europa og Afrika, hvilke if. SSI er i gang i 2016.[70][71]
Folkesundhed
Verdenssundhedsorganisationen erklærede TB for en global sundhedsnødsituation i 1993.[6] I 2006 udviklede "Stop TB partnerskabet" en global plan til udryddelse af tuberkulose, hvis mål er at redde 14 million liv før 2015.[72] Flere af deres mål kan næppe nås inden 2015, især på grund af stigningen i HIV-relaterede TB-tilfælde, og fordi der er opstået multiresistent tuberkulose.[6] Et system til tuberkuloseklassificering, som er udviklet af American Thoracic Society bliver brugt i folkesundhedsprogrammer.[73]
Behandling
Dette afsnit er forældet |
TB behandles med antibiotika, der slår bakterierne ned. Det er svært at behandle TB effektivt på grund af den usædvanlige opbygning og kemiske sammensætning af mykobakteriernes cellevægge. Cellevæggen holder medicinen ude, så meget antibiotika ikke virker.[74] De to mest anvendte typer antibiotika er isoniazid og rifampicin, og en behandling kan tage flere måneder.[40] Latent TB behandles sædvanligvis med et enkelt antibiotikum.[75] Aktiv TB behandles bedst med en kombination af flere antibiotika for at mindske risikoen for at bakterierne udvikler antibiotikaresistens.[6] Personer med latente infektioner modtager også behandling, så de ikke udvikler aktiv TB senere i livet.[75] WHO anbefaler DOTS-behandling. DOTS står for "directly observed therapy" og betyder, at sundhedspersonalet skal se, at personen tager sin medicin. Målet er at nedbringe antallet af personer, der ikke tager medicinen korrekt.[76] Dog er der ikke mange beviser for, at DOTS er effektiv.[77] Metoder, der husker folk på, at behandlingen er vigtig, er effektive.[78]
Nyt udbrud
I skrivende stund (2010) behandles nye udbrud af lungetuberkulose med en kombination af antibiotika i seks måneder. I de første to måneder gives rifampicin, isoniazid, pyrazinamid og ethambutol. I de sidste fire måneder gives kun rifampicin og isoniazid.[6] Hvis resistensen mod isoniazid er høj, kan der bruge ethambutol i de sidste fire måneder.[6]
Tilbagevendende sygdom
Hvis tuberkulosen vender tilbage, skal der tages prøver for at fastslå, hvilke antibiotika, den er sensitiv overfor, før man fastlægger behandlingen.[6] Hvis tuberkulosen er multiresistent, anbefales det at behandle den med mindst fire effektive antibiotika i mindst 18-24 måneder.[6]
Lægemiddelresistens
Primær resistens opstår, hvis en person smittes med en resistent stamme af TB. En person med modtagelig TB kan udvikle sekundær resistens ved behandlingen. En person kan udvikle sekundær resistens på grund af utilstrækkelig behandling, hvis de ikke tager de ordinerede lægemidler korrekt, eller hvis de bruger lægemidler af lav kvalitet.[79] Resistent TB er et stort problem for folkesundheden i mange udviklingslande. Resistent TB skal behandles i længere tid og med dyrere midler. En TB defineres som multiresistent, hvis den er resistent over for de to mest effektive førstelinjebehandlinger, rifampicin og isoniazid. Ekstremt resistent tuberkulose er også resistent over for tre eller flere af de seks klasser af andenlinjelægemidler.[80] Total resistent tuberkulose er resistent over for samtlige eksisterende lægemidler. Total resistent TB blev først opdaget i 2003 i Italien, men det blev ikke meldt før i 2012.[81]
Prognose
Dette afsnit er forældet |
En TB-infektion overgår til TB-sygdom, når bakterierne overvinder immunsystemets forsvarsmekanismer og begynder at formere sig. Ved primær TB (ca. 1-5% af tilfældene) sker overgangen hurtigt efter den første infektion.[1] Men i de fleste tilfælde bliver det til en latent infektion uden synlige symptomer.[1] Den latente infektion bliver til aktiv tuberkulose i 5–10% af tilfældene, og det sker tit mange år efter infektionen.[8]
Risikoen øges, hvis immunforsvaret svækkes, som det fx er tilfældet, hvis man inficeres med HIV. De, der både er inficeret med “M. tuberculosis” og HIV, har 10% højere risiko for en genaktivering pr. år.[1] Studier, som anvender dna-fingeraftryk af “M. tuberculosis”-stammer, viser, at folk, der smittes med TB igen, har en større risiko for en opblussen, end man tidligere har ment.[82] Gentagen smitte kan være ansvarlig for over 50% af de genaktiverede tilfælde i områder med udbredt TB.[83] Risikoen for at dø af tuberkulose var ca. 4% i 2008. Tallet er faldet fra 8% i 1995.[6]
Epidemiologi
Dette afsnit er forældet |

Cirka en tredjedel af verdens befolkning er smittet med “M. tuberculosis.” En person bliver smittet hvert sekund på verdensplan.[3] Men de fleste infektioner med “M. tuberculosis” fører ikke til, at man får TB,[85] og 90–95% af infektionerne er symptomfrie.[42] I 2007 regner man med, at der var 13,7 millioner kroniske aktive tilfælde.[4] I 2010 blev der diagnosticeret 8,8 millioner nye tilfælde af TB, og 1,45 millioner døde. De fleste af disse i udviklingslandene.[5] Af de 1,45 dødsfald var 0,35 millioner også smittet med HIV.[86]
Tuberkulose er den næstmest udbredte dødsårsag blandt infektionssygdommene (kun overgået af HIV/AIDS).[9] Det samlede antal af tuberkulosetilfælde ("udbredelse") har været faldende siden 2005. Antallet af nye tuberkulosetilfælde er faldet siden 2002.[5] Især i Kina er der sket store fremskridt. Kinas dødelighed som følge af TB er faldet med ca. 80% mellem 1990 og 2010.[86] Tuberkulose er mere udbredt i udviklingslandene. Ca. 80% af befolkningen i mange asiatiske og afrikanske lande tester positiv ved tuberkulinprøver, mens tallet i USA kun er 5-10%.[1] Eksperter have håbet, at TB kunne komme helt under kontrol. Men flere faktorer har gjort dette usandsynligt. Det har været svært at udvikle en effektiv vaccine. Det er dyrt og tager tid at diagnosticere sygdommen. Behandlingen tager mange måneder. Flere HIV-patienter udvikler TB. Der opstod modstandsdygtig TB i 1980'erne.[6]

I 2007 var det land, man anslog, der havde de fleste tilfælde af TB, Swaziland med 1.200 tilfælde pr. 100.000 indbyggere. Indien havde det største samlede antal tilfælde med et anslået antal på 2,0 millioner.[4] I i-landene er tuberkulose mindre udbredt og ses mest i byområderne. I 2010 var antallet af TB-patienter pr. 100.000 indbyggere i forskellige dele af verden: Globalt 178, Afrika 332, Nord- og Sydamerika 36, det østlige Middelhavsområde 173, Europa 63, Sydøstasien 278, og den vestlige Stillehavsregion 139.[86] I Canada og Australien er tuberkulose meget mere udbredt blandt den oprindelige befolkning især i fjerntliggende områder.[88][89] I USA har den oprindelige befolkning en fem gange så høj dødelighed af TB.[90]
Udbredelsen af TB svinger med alderen. I Afrika rammer det mest børn, unge mellem 12 og 18 og unge mennesker.[91] Men i de lande, såsom USA, hvor der er meget færre tilfælde, er TB mest en sygdom, der rammer de ældre og folk med svækket immunforsvar.[1][92]
Historie

Mennesket har lidt af tuberkulose siden oldtiden.[6] De første spor af “M. tuberculosis” er spor af sygdommen i resterne af en bison fra for ca. 17.000 år siden.[93] Det er dog ikke klart, om tuberkulose opstod i kvæg og så blev overført til mennesket, eller om det er kommet fra en fælles ane.[94] Forskere har tidligere troet, at mennesket fik tuberkulose fra dyr, da man begyndte af holde husdyr. Men generne i “M. tuberculosis”-komplekset i mennesker er blevet sammenlignet med dem fra dyr, og det har modbevist teorien. Begge stammer af tuberkulosebakterien har en fælles stamfader, som måske har inficeret mennesker helt tilbage til den neolitiske revolution.[95] Skeletdele viser, at forhistoriske mennesker (4000 f.Kr.) havde TB. Forskere har fundet tuberkuløse skeletændringer i egyptiske mumier fra 3000–2400 f.Kr.[96] "Phthisis" er et græsk ord for “tæring,” som er en gammel betegnelse for lungetuberkulose.[97] Omkring 460 f.Kr. identificerede Hippocrates phthisis som datidens mest udbredte sygdom. Folk med phthisis fik feber og hostede blod op. Phthisis havde næsten altid dødelig udgang.[98] Genetiske studier tyder på, at der var TB i Nord- og Sydamerika fra ca. år 100 e.Kr.[99]
Før den industrielle revolution forbandt man tit i folkeovertroen tuberkulose med vampyrer. Når et medlem af en familie døde af TB, kunne de andre smittede i familien også sygne langsomt hen. Man troede, at den første TB-patient havde suget livet ud af de andre.[100]
I 1689 etablerede Dr. Richard Morton den lungetuberkulose, man får af tuberkler som diagnose.[101][102] Men TB gav mange symptomer, så TB blev ikke identificeret som en enkelt sygdom før i 1820'erne. Det blev ikke kaldt tuberkulose før i 1839 af J. L. Schönlein.[103] Fra 1838 til 1845 bragte Dr. John Croghan, der ejede Mammoth Cave, folk med tuberkulose til hulen, i håb om at helbrede sygdommen med den konstante temperatur og den rene huleluft. De døde inden for et år.[104] Hermann Brehmer åbnede det første TB-sanatorium i 1859 i Sokołowsko, Polen.[105]
I 1865 mente den danske karantænelæge Peter Christian Lund, at TB kunne overføres fra dyr til mennesker på basis af forsøg med inficeret komælk til et barn. Hans forsøg blev i 1879 beskrevet i det medicinske tidsskrift "Nordiskt Medicinskt Arkiv" vol. 11. [106]

Den bakterie, der giver tuberkulose, “Mycobacterium tuberculosis", blev identificeret og beskrevet den 24. marts 1882 af Robert Koch. Han modtog Nobelprisen i fysiologi eller medicin i 1905 for opdagelsen.[107] Koch mente ikke, at kvægtuberkulose og menneskelig tuberkulose var det samme. Det gjorde, at det tog længere tid, før man indså, at inficeret mælk var en smittekilde. Senere blev risikoen for overførsel ad denne vej kraftigt reduceret, da man opfandt pasteuriseringsprocessen. Koch erklærede, at et glycerin-ekstrakt af tuberkel-bakterierne var en "kur" for tuberkulose i 1890. Han kaldte det "tuberkulin". Selvom "tuberkulin" ikke var effektivt, kunne det anvendes til at undersøge, om en person havde præsymptomatisk tuberkulose.[108]
Albert Calmette og Camille Guérin var de første, der immuniserede imod tuberkulose i 1906. De bruge en svækket stamme af kvægtuberkulose, og de kaldte vaccinen BCG (bacille Calmette-Guérin). På dansk kaldes den calmette-vaccinen. Calmette-vaccinen blev først brugt på mennesker i 1921 i Frankrig,[109] men det var først efter anden verdenskrig, at dens anvendelse blev almindelig udbredt i USA, Storbritannien og Tyskland.[110]
Tuberkulose var et stort problem i det 19. og det tidlige 20. århundrede, da det var en endemisk sygdom blandt de fattige i storbyerne. I 1815 skyldtes et af fire dødsfald i England "tæring". I 1918 var TB skyld i et ud af seks dødsfald i Frankrig. Da videnskaben i 1880'erne opdagede, at TB var smitsom, kom den på listen over anmeldelsespligtige sygdomme i Storbritannien. Der blev indledt kampagner mod at spytte på offentlige steder, og de smittede fattige blev "opmuntret" til at tage på sanatorier, der mindede om fængsler. Sanatorier for de bedre stillede ydede strålende pleje og konstant medicinsk behandling.[105] Sanatorierne skulle give "frisk luft" og fysisk arbejde. Men selv under de bedste forhold, døde 50% af patienterne inden for fem år ("ca." 1916).[105]
I Europa begyndte tuberkulose at blive mere udbredt tidligt i 1600-tallet. TB var på sit højeste i Europa i 1800-tallet, da det var skyld i næsten 25% af alle dødsfald.[111] Dødeligheden faldt med næsten 90% i 1950'erne.[112] En forbedring af folkesundheden gjorde indhug i tuberkulosetallene, selv før streptomycin og andre typer antibiotika blev taget i brug. Men sygdommen var stadig en trussel for folkesundheden. Da Medical Research Council blev dannet i Storbritannien i 1913 var det først med fokus på tuberkuloseforskning.[113]
I 1946 gjorde streptomycin det muligt effektivt at behandle TB. Før dette lægemiddel blev indført, var den eneste behandling (bortset fra sanatorier) kirurgiske indgreb. Med "pneumothorax-teknikken" punkteres en inficeret lunge, så den kan hvile, og tuberkuloselæsionerne kan heles.[114] Multiresistent TB har gjort det acceptabelt igen at anvende kirurgi som behandling mod TB-infektioner. Ved de moderne indgreb fjernes syge brysthulrum (kaverner) i lungerne for at mindste antallet af bakterier og give lægemidlerne i blodårerne bedre adgang til de tilbageværende bakterier. Indgrebet begrænser det totale antal bakterier og øger effektiviteten af systemisk antibiotikabehandling.[115] Eksperterne havde håbet, de helt kunne udrydde TB (se også kopper), men de modstandsdygtige stammer, der er opstået siden 1980'erne gør det mindre sandsynligt. Tuberkulose kom så stærkt tilbage, at WHO i 1993 erklærede det en global sundhedsnødsituation.[116]
Samfund og kultur
Dette afsnit er forældet |
Verdenssunhedsorganisationen og Bill and Melinda Gates Foundation støtter en ny hurtigvirkende test, der kan bruges i lande med en lav eller mellemhøj indtægt.[117][118] I 2011 har mange fattige steder stadig kun adgang til dyrkning af opspyt.[119]
I 2010 havde Indien det højeste antal TB-tilfælde på verdensplan. En af årsagerne er, at det private sundhedsvæsen ikke behandler sygdommen godt. Programmer som Revised National Tuberculosis Control Program er med til at reducere TB-niveauet blandt dem, der er under et offentligt sundhedsvæsen.[120][121]
Forskning
Dette afsnit er forældet |
Calmette-vaccinen har sine begrænsninger, og der forskes stadig i at udvikle nye TB-vacciner.[122] Flere potentielle kandidater er nu i fase I og II kliniske forsøg.[122] To hovedstrategier forsøger at forbedre de eksisterende vacciners effektivitet. Det ene tilføjer en subenhedsvaccine til calmette-vaccinen. Den anden strategi prøver at skaber nye og bedre levende vacciner.[122] MVA85A er et eksempel på en subenhedsvaccine, der er i forsøgsstadiet i Sydafrika. MVA85A er baseret på en genetisk modificeret vaccinia-virus.[123] Det håbes, at vaccination kan spille en stor rolle i behandlingen af latent og aktiv TB.[124]
For at fremme yderligere opdagelser har forskere og politiske beslutningstagere udviklet nye økonomiske modeller for udvikling af vacciner, bl.a. priser, skatteincitamenter og AMC.[125][126] Flere grupper deltager i forskningen, bl.a. Stop TB Partnership,[127] South African Tuberculosis Vaccine Initiative og Aeras Global TB Vaccine Foundation.[128] Aeras Global TB Vaccine Foundation modtog i 2007 en gave på over 280 million US dollar fra Bill and Melinda Gates Foundation til at udvikle og få godkendt en forbedret vaccine mod tuberkulose, der kan bruges i hårdt belastede lande.[129][130]
Hos andre dyr
Mykobakterier rammer mange dyr og fugle,[131] gnavere,[132] og krybdyr.[133] Underarten “Mycobacterium tuberculosis” ses sjældent hos vilde dyr.[134] Der har været bestræbelser i gang for at udrydde kvægtuberkulose, der skyldes “Mycobacterium bovis”, hos kvæg- og hjortebestande i New Zealand, og de har været ret vellykkede.[135] Bestræbelser i Storbritannien har ikke haft samme held.[136][137]
Tuberkulose er den mest almindelige dødelige infektionssygdom i verden i dag. Den forårsages af en mykobakterie, normalt Mycobacterium tuberculosis, men andre af det såkaldte tuberkulosekompleks kan også give tuberkulose. Smitten sker ved dråbeinfektion, i det bakterierne indåndes i mikroskopiske vanddråber, der kommer fra en anden person med lungetuberkulose. Ved hoste, tale og nysen spredes de små dråber i luften. Tuberkulose angriber som oftest lungerne. Infektionen kan dog ramme centralnervesystemet ved at sprede sig med blodet.
Antibiotikaresistente bakterier gør det vanskeligt at behandle sygdommen. På verdensplan dør ca. 1,4 million mennesker hvert år af tuberkulose.[138]
Historie
Forskerne mener, at tuberkulosen bevægede sig som en zoonose fra drøvtyggere til mennesker i egyptisk bondestenalder. Spor af tuberkulose er fundet i skeletter fra Nubien og Egypten fra ca 3000 f.Kr.[139] Tuberkulose var kommet til Danmark ca 500 f.Kr. Franske forskere har fundet tre millioner år gamle spor af sygdommen i det østlig Afrika.[140]
I Danmark er sygdommen kaldt lungesot. Den er beskrevet som en af de største dødsårsager i 1800'tallet.[141]
Behandling af tuberkulose
Da mykobakterierne er lejret inden i kroppens celler, har de fleste antibiotika dårlig eller ingen effekt, hvorfor det er obligatorisk at behandle med 3-4 stoffer samtidigt. Endvidere har mykobakterierne en lang delingstid, hvorfor man er nødt til at fortsætte behandlingen i 6 måneder. Som følge af den lange behandlingstid øges risikoen for bivirkninger og fremkaldelse af antibiotikaresistens.[142]
Resistente tuberkulosebakterier
Den multiresistente Mycobacterium Tuberculosis er i dag skyld i 190.000 årlige dødsfald på verdensplan, et tal der forventes at stige voldsomt i takt med den stigende antibiotikaresistens [143] I begyndelsen af 2013 opererer sundhedsvæsenet med tre typer resistente tuberkulosebakterier: multiresistente, ekstremt resistente og fuldkommen resistente eller totalt resistente tuberkulosebakterier, der kræver meget lang og kostbar antibiotikabehandling og for de totalt resistente en eksperimentel behandling, hvis udfald ikke kan forudsiges.[144]
Et hold forskere på Albert Einstein College of Medicine i New York, USA, har i 2013 ved et tilfælde opdaget, at almindeligt C-vitamin kan dræbe resistente turberkulose bakterier in vitro (laboratorieforsøg). Forskerne opfordrer til yderligere studier i den potentielle anvendelse af C-vitamin som turbekulose behandling.[145][146]
Referencer
- ^ a b c d e f g h i j k l m n o p q Kumar V, Abbas AK, Fausto N, Mitchell RN (2007). Robbins Basic Pathology (8 udgave). Saunders Elsevier. s. 516-522. ISBN 978-1-4160-2973-1.
{{cite book}}: CS1-vedligeholdelse: Flere navne: authors list (link) - ^ Konstantinos A (2010). "Testing for tuberculosis". Australian Prescriber. 33 (1): 12-18.
- ^ a b c d e "Tuberculosis Fact sheet N°104". World Health Organization. november 2010. Hentet 26. juli 2011.
- ^ a b c World Health Organization (2009). "Epidemiology" (PDF). Global tuberculosis control: epidemiology, strategy, financing. s. 6-33. ISBN 978-92-4-156380-2. Hentet 12. november 2009. (Webside ikke længere tilgængelig)
- ^ a b c d e World Health Organization (2011). "The sixteenth global report on tuberculosis" (PDF).
- ^ a b c d e f g h i j k l m n o p q r s t u v Lawn, SD; Zumla, AI (2. juli 2011). "Tuberculosis". Lancet. 378 (9785): 57-72. doi:10.1016/S0140-6736(10)62173-3. PMID 21420161.
- ^ Schiffman G (15. januar 2009). "Tuberculosis Symptoms". eMedicineHealth.
- ^ a b c d al., edited by Peter G. Gibson ; section editors, Michael Abramson ... [et (2005). Evidence-based respiratory medicine (1. publ. udgave). Oxford: Blackwell. s. 321. ISBN 978-0-7279-1605-1.
{{cite book}}:|first=har et generisk navn (hjælp) - ^ a b c d e f g h Dolin, [edited by] Gerald L. Mandell, John E. Bennett, Raphael (2010). Mandell, Douglas, and Bennett's principles and practice of infectious diseases (7 udgave). Philadelphia, PA: Churchill Livingstone/Elsevier. s. Chapter 250. ISBN 978-0-443-06839-3.
{{cite book}}:|first=har et generisk navn (hjælp) - ^ Behera, D. (2010). Textbook of pulmonary medicine (2 udgave). New Delhi: Jaypee Brothers Medical Pub. s. 457. ISBN 978-81-8448-749-7.
- ^ Jindal, editor-in-chief SK. Textbook of pulmonary and critical care medicine. New Delhi: Jaypee Brothers Medical Publishers. s. 549. ISBN 978-93-5025-073-0.
{{cite book}}:|first=har et generisk navn (hjælp) - ^ a b Golden MP, Vikram HR (2005). "Extrapulmonary tuberculosis: an overview". American family physician. 72 (9): 1761-8. PMID 16300038.
- ^ Kabra, [edited by] Vimlesh Seth, S.K. (2006). Essentials of tuberculosis in children (3 udgave). New Delhi: Jaypee Bros. Medical Publishers. s. 249. ISBN 978-81-8061-709-6.
{{cite book}}:|first=har et generisk navn (hjælp) - ^ a b Ghosh, editors-in-chief, Thomas M. Habermann, Amit K. (2008). Mayo Clinic internal medicine : concise textbook. Rochester, MN: Mayo Clinic Scientific Press. s. 789. ISBN 978-1-4200-6749-1.
{{cite book}}:|first=har et generisk navn (hjælp) - ^ Southwick F (10. december 2007). "Chapter 4: Pulmonary Infections". Infectious Diseases: A Clinical Short Course, 2nd ed. McGraw-Hill Medical Publishing Division. s. 104. ISBN 0-07-147722-5. Arkiveret fra originalen 13. juli 2012. Hentet 12. januar 2014.
{{cite book}}: Mere end en|pages=og|page=angivet (hjælp) - ^ Jindal, editor-in-chief SK. Textbook of pulmonary and critical care medicine. New Delhi: Jaypee Brothers Medical Publishers. s. 525. ISBN 978-93-5025-073-0.
{{cite book}}:|first=har et generisk navn (hjælp) - ^ Niederweis M, Danilchanka O, Huff J, Hoffmann C, Engelhardt H (marts 2010). "Mycobacterial outer membranes: in search of proteins". Trends in Microbiology. 18 (3): 109-16. doi:10.1016/j.tim.2009.12.005. ISSN 0966-842X. PMC 2931330. PMID 20060722.
{{cite journal}}: CS1-vedligeholdelse: Flere navne: authors list (link) - ^ a b Madison B (2001). "Application of stains in clinical microbiology". Biotech Histochem. 76 (3): 119-25. doi:10.1080/714028138. PMID 11475314.
- ^ Parish T, Stoker N (1999). "Mycobacteria: bugs and bugbears (two steps forward and one step back)". Molecular Biotechnology. 13 (3): 191-200. doi:10.1385/MB:13:3:191. PMID 10934532.
- ^ Medical Laboratory Science: Theory and Practice. New Delhi: Tata McGraw-Hill. 2000. s. 473. ISBN 0-07-463223-X.
- ^ Piot, editors, Richard D. Semba, Martin W. Bloem; foreword by Peter (2008). Nutrition and health in developing countries (2 udgave). Totowa, NJ: Humana Press. s. 291. ISBN 978-1-934115-24-4.
{{cite book}}:|first=har et generisk navn (hjælp) - ^ van Soolingen D; et al. (1997). "A novel pathogenic taxon of the Mycobacterium tuberculosis complex, Canetti: characterization of an exceptional isolate from Africa". International Journal of Systematic Bacteriology. 47 (4): 1236-45. doi:10.1099/00207713-47-4-1236. PMID 9336935.
- ^ Niemann S; et al. (2002). "Mycobacterium africanum Subtype II Is Associated with Two Distinct Genotypes and Is a Major Cause of Human Tuberculosis in Kampala, Uganda". J. Clin. Microbiol. 40 (9): 3398-405. doi:10.1128/JCM.40.9.3398-3405.2002. PMC 130701. PMID 12202584.
- ^ Niobe-Eyangoh SN; et al. (2003). "Genetic Biodiversity of Mycobacterium tuberculosis Complex Strains from Patients with Pulmonary Tuberculosis in Cameroon". J. Clin. Microbiol. 41 (6): 2547-53. doi:10.1128/JCM.41.6.2547-2553.2003. PMC 156567. PMID 12791879.
- ^ Thoen C, Lobue P, de Kantor I (2006). "The importance ofMycobacterium bovis as a zoonosis". Vet. Microbiol. 112 (2-4): 339-45. doi:10.1016/j.vetmic.2005.11.047. PMID 16387455.
{{cite journal}}: CS1-vedligeholdelse: Flere navne: authors list (link) - ^ Acton, Q. Ashton (2011). Mycobacterium Infections: New Insights for the Healthcare Professional. ScholarlyEditions. s. 1968. ISBN 978-1-4649-0122-5.
- ^ Pfyffer, GE; Auckenthaler, R; van Embden, JD; van Soolingen, D (oktober-december 1998). "Mycobacterium canettii, the smooth variant of M. tuberculosis, isolated from a Swiss patient exposed in Africa". Emerging infectious diseases. 4 (4): 631-4. PMID 9866740.
{{cite journal}}: CS1-vedligeholdelse: Dato-format (link) - ^ Panteix, G; Gutierrez, MC; Boschiroli, ML; Rouviere, M; Plaidy, A; Pressac, D; Porcheret, H; Chyderiotis, G; Ponsada, M; Van Oortegem, K; Salloum, S; Cabuzel, S; Bañuls, AL; Van de Perre, P; Godreuil, S (august 2010). "Pulmonary tuberculosis due to Mycobacterium microti: a study of six recent cases in France". Journal of medical microbiology. 59 (Pt 8): 984-9. PMID 20488936.
{{cite journal}}: CS1-vedligeholdelse: Flere navne: authors list (link) - ^ American Thoracic Society (1997). "Diagnosis and treatment of disease caused by nontuberculous mycobacteria. This official statement of the American Thoracic Society was approved by the Board of Directors, March 1997. Medical Section of the American Lung Association". Am J Respir Crit Care Med. 156 (2 Pt 2): S1-25. PMID 9279284.
- ^ World Health Organization. "Global tuberculosis control–surveillance, planning, financing WHO Report 2006". Hentet 13. oktober 2006.
- ^ Chaisson, RE; Martinson, NA (13. marts 2008). "Tuberculosis in Africa--combating an HIV-driven crisis". The New England Journal of Medicine. 358 (11): 1089-92. doi:10.1056/NEJMp0800809. PMID 18337598.
- ^ Griffith D, Kerr C (1996). "Tuberculosis: disease of the past, disease of the present". J Perianesth Nurs. 11 (4): 240-5. doi:10.1016/S1089-9472(96)80023-2. PMID 8964016.
- ^ ATS/CDC Statement Committee on Latent Tuberculosis Infection (9. juni 2000). "Targeted tuberculin testing and treatment of latent tuberculosis infection. American Thoracic Society". MMWR Recomm Rep. 49 (RR-6): 1-51. PMID 10881762.
{{cite journal}}:|author1=har et generisk navn (hjælp) - ^ van Zyl Smit, =RN; Pai, M; Yew, WW; Leung, CC; Zumla, A; Bateman, ED; Dheda, K (januar 2010). "Global lung health: the colliding epidemics of tuberculosis, tobacco smoking, HIV and COPD". The European respiratory journal : official journal of the European Society for Clinical Respiratory Physiology. 35 (1): 27-33. PMID 20044459.
These analyses indicate that smokers are almost twice as likely to be infected with TB and to progress to active disease (RR of ∼1.5 for latent TB infection (LTBI) and RR of ∼2.0 for TB disease). Smokers are also twice as likely to die from TB (RR of ∼2.0 for TB mortality), but data are difficult to interpret because of heterogeneity in the results across studies.
{{cite journal}}: CS1-vedligeholdelse: Flere navne: authors list (link) - ^ Restrepo, BI (15. august 2007). "Convergence of the tuberculosis and diabetes epidemics: renewal of old acquaintances". Clinical infectious diseases : an official publication of the Infectious Diseases Society of America. 45 (4): 436-8. doi:10.1086/519939. PMC 2900315. PMID 17638190.
- ^ Möller, M; Hoal, EG (marts 2010). "Current findings, challenges and novel approaches in human genetic susceptibility to tuberculosis". Tuberculosis (Edinburgh, Scotland). 90 (2): 71-83. doi:10.1016/j.tube.2010.02.002. PMID 20206579.
- ^ Cole E, Cook C (1998). "Characterization of infectious aerosols in health care facilities: an aid to effective engineering controls and preventive strategies". Am J Infect Control. 26 (4): 453-64. doi:10.1016/S0196-6553(98)70046-X. PMID 9721404.
- ^ Nicas M, Nazaroff WW, Hubbard A (2005). "Toward understanding the risk of secondary airborne infection: emission of respirable pathogens". J Occup Environ Hyg. 2 (3): 143-54. doi:10.1080/15459620590918466. PMID 15764538.
{{cite journal}}: CS1-vedligeholdelse: Flere navne: authors list (link) - ^ a b Ahmed N, Hasnain S (2011). "Molecular epidemiology of tuberculosis in India: Moving forward with a systems biology approach". Tuberculosis. 91 (5): 407-3. doi:10.1016/j.tube.2011.03.006. PMID 21514230.
- ^ a b "Core Curriculum on Tuberculosis: What the Clinician Should Know" (PDF) (5 udgave). Centers for Disease Control and Prevention (CDC), Division of Tuberculosis Elimination. 2011. s. 24.
- ^ "Causes of Tuberculosis". Mayo Clinic. 21. december 2006. Hentet 19. oktober 2007.
- ^ a b Skolnik, Richard (2011). Global health 101 (2 udgave). Burlington, MA: Jones & Bartlett Learning. s. 253. ISBN 978-0-7637-9751-5.
- ^ a b editors, Arch G. Mainous III, Claire Pomeroy, (2009). Management of antimicrobials in infectious diseases : impact of antibiotic resistance (2nd rev. ed. udgave). Totowa, N.J.: Humana. s. 74. ISBN 978-1-60327-238-4.
{{cite book}}:|edition=har ekstra tekst (hjælp);|last=har et generisk navn (hjælp)CS1-vedligeholdelse: Ekstra punktum (link) - ^ Houben E, Nguyen L, Pieters J (2006). "Interaction of pathogenic mycobacteria with the host immune system". Curr Opin Microbiol. 9 (1): 76-85. doi:10.1016/j.mib.2005.12.014. PMID 16406837.
{{cite journal}}: CS1-vedligeholdelse: Flere navne: authors list (link) - ^ Khan (2011). Essence Of Paediatrics. Elsevier India. s. 401. ISBN 978-81-312-2804-3.
- ^ Herrmann J, Lagrange P (2005). "Dendritic cells and Mycobacterium tuberculosis: which is the Trojan horse?". Pathol Biol (Paris). 53 (1): 35-40. doi:10.1016/j.patbio.2004.01.004. PMID 15620608.
- ^ Agarwal R, Malhotra P, Awasthi A, Kakkar N, Gupta D (2005). "Tuberculous dilated cardiomyopathy: an under-recognized entity?". BMC Infect Dis. 5 (1): 29. doi:10.1186/1471-2334-5-29. PMC 1090580. PMID 15857515.
{{cite journal}}: CS1-vedligeholdelse: Flere navne: authors list (link) - ^ a b c Grosset J (2003). "Mycobacterium tuberculosis in the Extracellular Compartment: an Underestimated Adversary". Antimicrob Agents Chemother. 47 (3): 833-6. doi:10.1128/AAC.47.3.833-836.2003. PMC 149338. PMID 12604509.
- ^ Crowley, Leonard V. (2010). An introduction to human disease : pathology and pathophysiology correlations (8 udgave). Sudbury, Mass.: Jones and Bartlett. s. 374. ISBN 978-0-7637-6591-0.
- ^ Skolnik, Richard (2005). Global health 101 (2 udgave). Burlington, MA: Jones & Bartlett Learning. s. 75. ISBN 978-92-4-154634-8.
- ^ Jacob, JT; Mehta, AK; Leonard, MK (januar 2009). "Acute forms of tuberculosis in adults". The American journal of medicine. 122 (1): 12-7. PMID 19114163.
- ^ a b Bento, J; Silva, AS; Rodrigues, F; Duarte, R (januar-februar 2011). "Diagnostic tools in tuberculosis". Acta medica portuguesa. 24 (1): 145-54. PMID 21672452.
{{cite journal}}: CS1-vedligeholdelse: Dato-format (link) - ^ a b c d Escalante, P (2. juni 2009). "In the clinic. Tuberculosis". Annals of internal medicine. 150 (11): ITC61-614, quiz ITV616. PMID 19487708.
- ^ Metcalfe, JZ; Everett, CK; Steingart, KR; Cattamanchi, A; Huang, L; Hopewell, PC; Pai, M (15. november 2011). "Interferon-γ release assays for active pulmonary tuberculosis diagnosis in adults in low- and middle-income countries: systematic review and meta-analysis". The Journal of infectious diseases. 204 Suppl 4: S1120-9. PMID 21996694.
- ^ a b Sester, M; Sotgiu, G; Lange, C; Giehl, C; Girardi, E; Migliori, GB; Bossink, A; Dheda, K; Diel, R; Dominguez, J; Lipman, M; Nemeth, J; Ravn, P; Winkler, S; Huitric, E; Sandgren, A; Manissero, D (januar 2011). "Interferon-γ release assays for the diagnosis of active tuberculosis: a systematic review and meta-analysis". The European respiratory journal : official journal of the European Society for Clinical Respiratory Physiology. 37 (1): 100-11. PMID 20847080.
{{cite journal}}: CS1-vedligeholdelse: Flere navne: authors list (link) - ^ Chen, J; Zhang, R; Wang, J; Liu, L; Zheng, Y; Shen, Y; Qi, T; Lu, H (2011). "Interferon-gamma release assays for the diagnosis of active tuberculosis in HIV-infected patients: a systematic review and meta-analysis". PloS one. 6 (11): e26827. PMID 22069472.
{{cite journal}}: CS1-vedligeholdelse: Flere navne: authors list (link) - ^ Diseases, Special Programme for Research & Training in Tropical (2006). Diagnostics for tuberculosis : global demand and market potential. Geneva: World Health Organization on behalf of the Special Programme for Research and Training in Tropical Diseases. s. 36. ISBN 978-92-4-156330-7.
- ^ a b c Skabelon:NICE
- ^ Steingart, KR; Flores, LL; Dendukuri, N; Schiller, I; Laal, S; Ramsay, A; Hopewell, PC; Pai, M (august 2011). "Commercial serological tests for the diagnosis of active pulmonary and extrapulmonary tuberculosis: an updated systematic review and meta-analysis". PLoS medicine. 8 (8): e1001062. doi:10.1371/journal.pmed.1001062. PMC 3153457. PMID 21857806.
{{cite journal}}: CS1-vedligeholdelse: Flere navne: authors list (link) - ^ Rothel J, Andersen P (2005). "Diagnosis of latent Mycobacterium tuberculosis infection: is the demise of the Mantoux test imminent?". Expert Rev Anti Infect Ther. 3 (6): 981-93. doi:10.1586/14787210.3.6.981. PMID 16307510.
- ^ Pai M, Zwerling A, Menzies D (2008). "Systematic Review: T-Cell–based Assays for the Diagnosis of Latent Tuberculosis Infection: An Update". Ann. Intern. Med. 149 (3): 1-9. PMC 2951987. PMID 18593687.
{{cite journal}}: CS1-vedligeholdelse: Flere navne: authors list (link) - ^ Jindal, editor-in-chief SK. Textbook of pulmonary and critical care medicine. New Delhi: Jaypee Brothers Medical Publishers. s. 544. ISBN 978-93-5025-073-0.
{{cite book}}:|first=har et generisk navn (hjælp) - ^ Amicosante, M; Ciccozzi, M; Markova, R (april 2010). "Rational use of immunodiagnostic tools for tuberculosis infection: guidelines and cost effectiveness studies". The new microbiologica. 33 (2): 93-107. PMID 20518271.
- ^ McShane, H (12. oktober 2011). "Tuberculosis vaccines: beyond bacille Calmette–Guérin". Philosophical transactions of the Royal Society of London. Series B, Biological sciences. 366 (1579): 2782-9. doi:10.1098/rstb.2011.0097. PMC 3146779. PMID 21893541.
- ^ "Vaccine and Immunizations: TB Vaccine (BCG)". Centers for Disease Control and Prevention. 2011. Hentet 26. juli 2011.
- ^ "BCG Vaccine Usage in Canada -Current and Historical". Public Health Agency of Canada. september 2010. Arkiveret fra originalen 30. marts 2012. Hentet 30. december 2011.
- ^ a b Teo, SS; Shingadia, DV (juni 2006). "Does BCG have a role in tuberculosis control and prevention in the United Kingdom?". Archives of Disease in Childhood. 91 (6): 529-31. doi:10.1136/adc.2005.085043. PMC 2082765. PMID 16714729.
- ^ Tuberculosis vaccine with high predicted population coverage and compatibility with modern diagnostics Arkiveret 5. marts 2021 hos Wayback Machine (PNAS).
- ^ Danske forskere laver ny vaccine mod tuberkulose (Videnskab.dk 14-01-2014).
- ^ [http://www.ssi.dk/English/News/RD-News/2014/Novel%20vaccine%20Trial%20TB.aspx Prevention of TB infection study underway in South Africa (SSI, 11-03-2014, hentet 24-06-2016)
- ^ Tuberkulose Vaccine Forskning (SSI, 11-05-2016, hentet 24-06-2017)
- ^ "The Global Plan to Stop TB". World Health Organization. 2011. Arkiveret fra originalen 12. juni 2011. Hentet 13. juni 2011.
- ^ Warrell, ed. by D. J. Weatherall ... [4. + 5. ed.] ed. by David A. (2005). Sections 1 - 10 (4. ed., paperback. udgave). Oxford [u.a.]: Oxford Univ. Press. s. 560. ISBN 978-0-19-857014-1.
{{cite book}}:|first=har et generisk navn (hjælp) - ^ Brennan PJ, Nikaido H (1995). "The envelope of mycobacteria". Annu. Rev. Biochem. 64: 29-63. doi:10.1146/annurev.bi.64.070195.000333. PMID 7574484.
- ^ a b Menzies, D; Al Jahdali, H; Al Otaibi, B (marts 2011). "Recent developments in treatment of latent tuberculosis infection". The Indian journal of medical research. 133: 257-66. PMID 21441678.
- ^ Arch G., III Mainous (2010). Management of Antimicrobials in Infectious Diseases: Impact of Antibiotic Resistance. Humana Pr. s. 69. ISBN 1-60327-238-0.
- ^ Volmink J, Garner P (2007). "Directly observed therapy for treating tuberculosis". Cochrane Database Syst Rev (4): CD003343. doi:10.1002/14651858.CD003343.pub3. PMID 17943789.
- ^ Liu, Q; Abba, K; Alejandria, MM; Balanag, VM; Berba, RP; Lansang, MA (8. oktober 2008). "Reminder systems and late patient tracers in the diagnosis and management of tuberculosis". Cochrane database of systematic reviews (Online) (4): CD006594. PMID 18843723.
- ^ O'Brien R (1994). "Drug-resistant tuberculosis: etiology, management and prevention". Semin Respir Infect. 9 (2): 104-12. PMID 7973169.
- ^ Centers for Disease Control and Prevention (CDC) (2006). "Emergence of Mycobacterium tuberculosis with extensive resistance to second-line drugs—worldwide, 2000–2004". MMWR Morb Mortal Wkly Rep. 55 (11): 301-5. PMID 16557213.
- ^ Maryn McKenna (12. januar 2012). "Totally Resistant TB: Earliest Cases in Italy". Wired. Hentet 12. januar 2012.
- ^ Lambert M; et al. (2003). "Recurrence in tuberculosis: relapse or reinfection?". Lancet Infect Dis. 3 (5): 282-7. doi:10.1016/S1473-3099(03)00607-8. PMID 12726976.
- ^ Wang, JY; Lee, LN; Lai, HC; Hsu, HL; Liaw, YS; Hsueh, PR; Yang, PC (15. juli 2007). "Prediction of the tuberculosis reinfection proportion from the local incidence". The Journal of infectious diseases. 196 (2): 281-8. doi:10.1086/518898. PMID 17570116.
{{cite journal}}: CS1-vedligeholdelse: Flere navne: authors list (link) - ^ World Health Organization (2009). "The Stop TB Strategy, case reports, treatment outcomes and estimates of TB burden". Global tuberculosis control: epidemiology, strategy, financing. s. 187-300. ISBN 978-92-4-156380-2. Arkiveret fra originalen 19. november 2009. Hentet 14. november 2009.
- ^ "Fact Sheets: The Difference Between Latent TB Infection and Active TB Disease". Centers for Disease Control. 20. juni 2011. Hentet 26. juli 2011.
- ^ a b c "Global Tuberculosis Control 2011" (PDF). World Health Organization. Hentet 15. april 2012.
- ^ World Health Organization. "WHO report 2008: Global tuberculosis control". Hentet 13. april 2009.
- ^ FitzGerald, JM; Wang, L; Elwood, RK (8. februar 2000). "Tuberculosis: 13. Control of the disease among aboriginal people in Canada". CMAJ : Canadian Medical Association journal = journal de l'Association medicale canadienne. 162 (3): 351-5. PMID 10693593.
{{cite journal}}: Mangler lodret streg i:|journal=(hjælp) - ^ Quah, Stella R.; Carrin, Guy; Buse, Kent; Kristian Heggenhougen (2009). Health Systems Policy, Finance, and Organization. Boston: Academic Press. s. 424. ISBN 0-12-375087-3.
{{cite book}}: CS1-vedligeholdelse: Flere navne: authors list (link) - ^ Anne-Emanuelle Birn (2009). Textbook of International Health: Global Health in a Dynamic World. s. 261. ISBN 9780199885213.
- ^ World Health Organization. "Global Tuberculosis Control Report, 2006 – Annex 1 Profiles of high-burden countries" (PDF). Arkiveret (PDF) fra originalen 16. juli 2006. Hentet 13. oktober 2006.
- ^ Centers for Disease Control and Prevention (12. september 2006). "2005 Surveillance Slide Set". Hentet 13. oktober 2006.
- ^ Rothschild BM; Martin LD; Lev G; et al. (august 2001). "Mycobacterium tuberculosis complex DNA from an extinct bison dated 17,000 years before the present". Clin. Infect. Dis. 33 (3): 305-11. doi:10.1086/321886. PMID 11438894.
- ^ Pearce-Duvet J (2006). "The origin of human pathogens: evaluating the role of agriculture and domestic animals in the evolution of human disease". Biol Rev Camb Philos Soc. 81 (3): 369-82. doi:10.1017/S1464793106007020. PMID 16672105.
- ^ Comas, I; Gagneux, S (oktober 2009). "The past and future of tuberculosis research". PLoS pathogens. 5 (10): e1000600. PMID 19855821.
- ^ Zink A, Sola C, Reischl U, Grabner W, Rastogi N, Wolf H, Nerlich A (2003). "Characterization of Mycobacterium tuberculosis Complex DNAs from Egyptian Mummies by Spoligotyping". J Clin Microbiol. 41 (1): 359-67. doi:10.1128/JCM.41.1.359-367.2003. PMC 149558. PMID 12517873.
{{cite journal}}: CS1-vedligeholdelse: Flere navne: authors list (link) - ^ The Chambers Dictionary. New Delhi: Allied Chambers India Ltd. 1998. s. 352. ISBN 978-81-86062-25-8.
- ^ Hippocrates.Aphorisms. Accessed 7 October 2006.
- ^ Konomi N, Lebwohl E, Mowbray K, Tattersall I, Zhang D (2002). "Detection of Mycobacterial DNA in Andean Mummies". J Clin Microbiol. 40 (12): 4738-40. doi:10.1128/JCM.40.12.4738-4740.2002. PMC 154635. PMID 12454182.
{{cite journal}}: CS1-vedligeholdelse: Flere navne: authors list (link) - ^ Sledzik, Paul S.; Bellantoni, Nicholas (juni 1994). "Bioarcheological and biocultural evidence for the New England vampire folk belief" (PDF). American Journal of Physical Anthropology. 94 (2): 269-274. doi:10.1002/ajpa.1330940210. ISSN 0002-9483. PMID 8085617.
- ^ Léon Charles Albert Calmette hos Who Named It?
- ^ Trail RR (april 1970). "Richard Morton (1637-1698)". Med Hist. 14 (2): 166-74. PMC 1034037. PMID 4914685.
- ^ Zur Pathogenie der Impetigines. Auszug aus einer brieflichen Mitteilung an den Herausgeber. [Müller’s] Archiv für Anatomie, Physiologie und wissenschaftliche Medicin. 1839, page 82.
- ^ Kentucky: Mammoth Cave long on history. Arkiveret 13. august 2006 hos Wayback Machine CNN. 27. februar 2004. Hentet 8. oktober 2006.
- ^ a b c McCarthy OR (august 2001). "The key to the sanatoria". J R Soc Med. 94 (8): 413-7. PMC 1281640. PMID 11461990. Arkiveret fra originalen 3. august 2012. Hentet 12. januar 2014.
- ^ "Anti-vivisection evidences" by Benjamin Bryan 1895
- ^ Nobel Foundation. The Nobel Prize in Physiology or Medicine 1905. Hentet 7. oktober 2006.
- ^ Waddington K (januar 2004). "To stamp out "So Terrible a Malady": bovine tuberculosis and tuberculin testing in Britain, 1890–1939". Med Hist. 48 (1): 29-48. PMC 546294. PMID 14968644.
- ^ Bonah C (2005). "The 'experimental stable' of the BCG vaccine: safety, efficacy, proof, and standards, 1921–1933". Stud Hist Philos Biol Biomed Sci. 36 (4): 696-721. doi:10.1016/j.shpsc.2005.09.003. PMID 16337557.
- ^ Comstock G (1994). "The International Tuberculosis Campaign: a pioneering venture in mass vaccination and research". Clin Infect Dis. 19 (3): 528-40. doi:10.1093/clinids/19.3.528. PMID 7811874.
- ^ Bloom, editor, Barry R. (1994). Tuberculosis : pathogenesis, protection, and control. Washington, D.C.: ASM Press. ISBN 978-1-55581-072-6.
{{cite book}}:|first=har et generisk navn (hjælp) - ^ Persson, Sheryl (2010). Smallpox, Syphilis and Salvation: Medical Breakthroughs That Changed the World. ReadHowYouWant.com. s. 141. ISBN 978-1-4587-6712-7.
- ^ editor, Caroline Hannaway, (2008). Biomedicine in the twentieth century: practices, policies, and politics. Amsterdam: IOS Press. s. 233. ISBN 978-1-58603-832-8.
{{cite book}}:|last=har et generisk navn (hjælp)CS1-vedligeholdelse: Ekstra punktum (link) - ^ Shields, Thomas (2009). General thoracic surgery (7 udgave). Philadelphia: Wolters Kluwer Health/Lippincott Williams & Wilkins. s. 792. ISBN 978-0-7817-7982-1.
- ^ Lalloo UG, Naidoo R, Ambaram A (maj 2006). "Recent advances in the medical and surgical treatment of multi-drug resistant tuberculosis". Curr Opin Pulm Med. 12 (3): 179-85. doi:10.1097/01.mcp.0000219266.27439.52. PMID 16582672. Arkiveret fra originalen 10. maj 2013. Hentet 12. januar 2014.
{{cite journal}}: CS1-vedligeholdelse: Flere navne: authors list (link) - ^ "Frequently asked questions about TB and HIV". World Health Organization. Arkiveret fra originalen 25. december 2004. Hentet 15. april 2012.
- ^ Lawn, SD; Nicol, MP (september 2011). "Xpert® MTB/RIF assay: development, evaluation and implementation of a new rapid molecular diagnostic for tuberculosis and rifampicin resistance". Future microbiology. 6 (9): 1067-82. PMID 21958145.
- ^ "WHO says Cepheid rapid test will transform TB care". Reuters. 8. december 2010.
- ^ Lienhardt, C; Espinal, M; Pai, M; Maher, D; Raviglione, MC (november 2011). "What research is needed to stop TB? Introducing the TB Research Movement". PLoS medicine. 8 (11): e1001135. doi:10.1371/journal.pmed.1001135. PMC 3226454. PMID 22140369.
- ^ Anurag Bhargava, Lancelot Pinto, Madhukar Pai (2011). "Mismanagement of tuberculosis in India: Causes, consequences, and the way forward". Hypothesis. 9 (1): e7. Arkiveret fra originalen 12. januar 2020. Hentet 12. januar 2014.
{{cite journal}}: CS1-vedligeholdelse: Flere navne: authors list (link) - ^ Amdekar, Y (juli 2009). "Changes in the management of tuberculosis". Indian journal of pediatrics. 76 (7): 739-42. PMID 19693453.
- ^ a b c Martín Montañés, C; Gicquel, B (marts 2011). "New tuberculosis vaccines". Enfermedades infecciosas y microbiologia clinica. 29 Suppl 1: 57-62. doi:10.1016/S0213-005X(11)70019-2. PMID 21420568.
- ^ Ibanga H, Brookes R, Hill P, Owiafe P, Fletcher H, Lienhardt C, Hill A, Adegbola R, McShane H (2006). "Early clinical trials with a new tuberculosis vaccine, MVA85A, in tuberculosis-endemic countries: issues in study design". Lancet Infect Dis. 6 (8): 522-8. doi:10.1016/S1473-3099(06)70552-7. PMID 16870530.
{{cite journal}}: CS1-vedligeholdelse: Flere navne: authors list (link) - ^ Kaufmann SH (2010). "Future vaccination strategies against tuberculosis: Thinking outside the box". Immunity. 33 (4): 567-77. doi:10.1016/j.immuni.2010.09.015. PMID 21029966.
- ^ Webber D, Kremer M (2001). "Stimulating Industrial R&D for Neglected Infectious Diseases: Economic Perspectives" (PDF). Bulletin of the World Health Organization. 79 (8): 693-801.
- ^ Barder O, Kremer M, Williams H (2006). "Advance Market Commitments: A Policy to Stimulate Investment in Vaccines for Neglected Diseases". The Economists' Voice. 3 (3). doi:10.2202/1553-3832.1144. Arkiveret fra originalen 5. november 2006. Hentet 12. januar 2014.
{{cite journal}}: CS1-vedligeholdelse: Flere navne: authors list (link) - ^ Economic (2009). Achieving the global public health agenda : dialogues at the Economic and Social Council. New York: United Nations. s. 103. ISBN 978-92-1-104596-3.
{{cite book}}: Mere end en|author=og|last=angivet (hjælp) - ^ Jong, [edited by] Jane N. Zuckerman, Elaine C. (2010). Travelers' vaccines (2 udgave). Shelton, CT: People's Medical Pub. House. s. 319. ISBN 978-1-60795-045-5.
{{cite book}}:|first=har et generisk navn (hjælp) - ^ Bill and Melinda Gates Foundation Announcement (2004-02-12). "Gates Foundation Commits $82.9 Million to Develop New Tuberculosis Vaccines". Arkiveret fra originalen 10. oktober 2009. Hentet 12. januar 2014.
- ^ Nightingale, Katherine (2007-09-19). "Gates foundation gives US$280 million to fight TB".
- ^ Shivaprasad, HL; Palmieri, C (januar 2012). "Pathology of mycobacteriosis in birds". The veterinary clinics of North America. Exotic animal practice. 15 (1): 41-55, v-vi. PMID 22244112.
- ^ Reavill, DR; Schmidt, RE (januar 2012). "Mycobacterial lesions in fish, amphibians, reptiles, rodents, lagomorphs, and ferrets with reference to animal models". The veterinary clinics of North America. Exotic animal practice. 15 (1): 25-40, v. PMID 22244111.
- ^ Mitchell, MA (januar 2012). "Mycobacterial infections in reptiles". The veterinary clinics of North America. Exotic animal practice. 15 (1): 101-11, vii. PMID 22244116.
- ^ Wobeser, Gary A. (2006). Essentials of disease in wild animals (1 udgave). Ames, Iowa [u.a.]: Blackwell Publ. s. 170. ISBN 978-0-8138-0589-4.
- ^ Ryan, TJ; Livingstone, PG; Ramsey, DS; de Lisle, GW; Nugent, G; Collins, DM; Buddle, BM (25. februar 2006). "Advances in understanding disease epidemiology and implications for control and eradication of tuberculosis in livestock: the experience from New Zealand". Veterinary microbiology. 112 (2-4): 211-9. PMID 16330161.
- ^ White, PC; Böhm, M; Marion, G; Hutchings, MR (september 2008). "Control of bovine tuberculosis in British livestock: there is no 'silver bullet'". Trends in microbiology. 16 (9): 420-7. PMID 18706814.
- ^ Ward, AI; Judge, J; Delahay, RJ (1. januar 2010). "Farm husbandry and badger behaviour: opportunities to manage badger to cattle transmission of Mycobacterium bovis?". Preventive veterinary medicine. 93 (1): 2-10. PMID 19846226.
- ^ Tuberkuklose. Statens Serum Institut
- ^ (s. 370)
- ^ Alt om historie, nr 2, 2005, side 6, Nyt fra historien
- ^ Alt om historie, nr 6, 2013, side 6, Tuberkulose nedbrød ofrenes lunger
- ^ Christophersen, Bolette et al. Kompendium i farmakologi (2. udgave, 2007). Foreningen Af Danske Lægestuderendes Forlag. ISBN 978-87-7749-368-3, side 236
- ^ "'Antibiotic apocalypse':doctors sound alarm over drug resistance". The Guardian. 2017-10-08. Hentet 2017-10-19.
- ^ Nu er tuberkulose praktisk talt uhelbredelig. Videnskab.dk marts 2013
- ^ C Slays TB Bacteria (The Scientist 21-05-2013)
- ^ "Forunderlige C-vitamin slår til igen – kan angiveligt virke mod multiresistent TB (Alternativinfo 30-05-2013)". Arkiveret fra originalen 26. marts 2014. Hentet 30. maj 2013.
Eksterne links
 | Wikimedia Commons har medier relateret til: |
- Ny dansk vaccine skal udrydde tuberkulose. Videnskab.dk, marts 2012
- Tuberkulose. netdoktor.dk
- Portrætter af verdens 12 farligste bakterier. Videnskab.dk
- Mirakelmedicin mod verdens værste bakterie. Illustreret videnskab, 2005 (Webside ikke længere tilgængelig)
- Tuberkulose, Læger uden Grænsers medicinske leksikon
Se også
- Luftvejsinfektion
- Lungebetændelse
- Antibiotikaresistens
- Miliærtuberkulose
- Kvægtuberkulose (bovin tuberkulose)
- Para-aminosalicylsyre (PAS)
- Streptomycin
- Isoniazid
- Ethambutol
- Pyrazinamid
- Rifampicin
Medier brugt på denne side
Forfatter/Opretter: David Vignoni (globe, clock face/ring), Anomie (clock hands), David Göthberg (making the clock red, shadows). Anomie and David G (putting all the parts together)., Licens: LGPL
Globe with clock to represent a "current event"
Forfatter/Opretter:
The original uploader was Yzmo at engelsk Wikipedia.
Later versions were uploaded by Tene at en.wikipedia., Licens: LGPLThis image is combined from the following two images.
This technician is in the process of correctly placing a Mantoux tuberculin skin test in this recipient’s forearm, which will cause a 6mm to10mm wheal, i.e., a raised area of skin surface, to form at the injection site. The Mantoux tuberculin skin test is used to evaluate people for latent tuberculosis (TB) infection. In the United States, this skin test consists of an intradermal injection of exactly one tenth of a milliliter (mL) of tuberculin, which contains 5 tuberculin units. Correct placement of this intradermal injection involves inserting the needle bevel slowly at a 5° to 15° angle. The needle bevel is advanced through the epidermis, the superficial layer of skin, approximately 3mm so that the entire bevel is covered and lies just under the skin surface. A tense, pale wheal that is 6mm to 10mm in diameter appears over the needle bevel.
Main symptoms of different variants and stages of tuberculosis (See Wikipedia:Tuberculosis), with many symptoms overlapping with other variants, while others are more (but not entirely) specific for certain variants. Multiple variants may be present simultaneously.
To discuss image, please see Template talk:Human body diagrams
Predominantly white poster with black and red lettering. Title at top of poster. Visual image is an illustration of a man holding a handkerchief over his mouth. Caption and publisher information below illustration.
Photomicrograph of a sputum sample containing Mycobacterium tuberculosis. M. tuberculosis bacteria can attack any part of the body, but usually the lungs causing Tuberculosis. It is spread when infected individuals cough or sneeze, releasing microdroplets into the air that contain the bacteria, which others then inhale.
An anteroposterior X-ray of a patient diagnosed with advanced bilateral pulmonary tuberculosis. This AP X-ray of the chest reveals the presence of bilateral pulmonary infiltrate (white triangles), and „caving formation“ (black arrows) present in the right apical region.The diagnosis is far-advanced tuberculosis.
Under a high magnification of 15549x, this scanning electron micrograph (SEM) depicted some of the ultrastructural details seen in the cell wall configuration of a number of Gram-positive Mycobacterium tuberculosis bacteria. As an obligate aerobic organism M. tuberculosis can only survive in an environment containing oxygen. This bacterium ranges in length between 2 - 4 microns, and a width between 0.2 - 0.5 microns. See PHIL 9997 for a colorized version of this image.
TB bacteria become active, and begin to multiply, if the immune system can't stop them from growing. The bacteria attack the body and destroy tissue. If in the lungs, the bacteria can actually create a hole in the lung tissue. Some people develop active TB disease soon after becoming infected, before their immune system can fight off the bacteria. Other people may get sick later, when their immune system becomes weak for another reason.
Babies and young children often have weak immune systems. People infected with HIV, the virus that causes AIDS, have very weak immune systems. Other people can have weak immune systems, too, especially people with any of these conditions: substance abuse; diabetes mellitus; silicosis; cancer of the head or neck; leukemia or Hodgkin's disease; severe kidney disease; low body weight; certain medical treatments (such as corticosteroid treatment or organ transplants); specialized treatment for rheumatoid arthritis, or Crohn's diseaseI am author, created from data in annex 2 of Global tuberculosis control - surveillance, planning, financing WHO Report 2006 http://www.who.int/tb/publications/global_report/2006/en/
Estimated prevalence of tuberculosis per 100,000 people in 2007, per country.











