Titan (grundstof)
 For alternative betydninger, se titan. (Se også artikler, som begynder med titan)
For alternative betydninger, se titan. (Se også artikler, som begynder med titan) "Titanium" omdirigeres hertil. For sangen, se Titanium (sang).
"Titanium" omdirigeres hertil. For sangen, se Titanium (sang).
Titan eller titanium er et grundstof med det kemiske symbol Ti og atomnummer 22. Det er et blankt sølvfarvet overgangsmetal med lav densitet og høj styrke. Titan er modstandsdygtigt overfor korrosion i havvand, kongevand og klor.
Titan blev opdaget i Cornwall, Storbritannien af William Gregor i 1791 og blev navngivet af Martin Heinrich Klaproth efter titanerne i græsk mytologi: Grundstoffet optræder i en række forskellige mineraler, særligt rutil og ilmenit, der er findes i større mængder i Jordens skorpe og lithosfære; det findes i stort set alt levende, samt i vand, klipper og jord.[1] Metallet kan udvindes fra malme via Kroll-[2] Hunterprocessen. Den mest almindelige titanforbindelse, titandioxid, er en almindelig fotokatalysator, og det bruges i fremstilling af hvide pigmenter.[3] Andre forbindelser inkluderer titantetraklorid (TiCl4), en komponent til røggranater og katalysatorer; og titantriklorid (TiCl3), der bruges som en katalysator til fremstilling af polypropylen.[1]
Titan kan bruges i legeringer med bl.a. jern, aluminium, vanadium og molybdæn til at fremstille stærke letvægtsmaterialer, der bruges til rumfarts- og flyindustrien (jetfly, rumfartøjer og missiler, militært, til industrielle processer (kemikalier og petrokemikalier, afsaltning, træmasse og papir), bilindustrien, landbrug, sundhedssektoren (proteser, implantater og tandimplantater, instrumenter og værktøj), sportsudstyr, smykker, mobiltelefoner og andre anvendelser.[1]
De to vigtigste egenskaber ved metallet er, at det er korrosionsbestandigt og har en høj styrke vs. densitet, hvilket er det højeste for noget metalgrundstof.[4] I sin rene form er titan lige så stærkt som nogle typer af stål, men har lavere densitet.[5] Der findes to allotropiske udgaver[6] og fem naturligt forekommende isotoper af dette grundstof 46Ti til 50Ti, hvor 48Ti er den mest naturligt forekommende (73,8%).[7] Selvom titanium har samme antal valenselektroner og er i samme gruppe som zirconium, så adskiller disse to grundstoffer sig på mange kemiske og fysiske egenskaber.
Egenskaber
Titan antager en af to allotropiske former, afhængigt af temperaturen: Under cirka 880 °C fremtræder stoffet i α-formen med hexagonal krystalstruktur, mens det over denne temperatur ganske langsomt forandres til den kubiske β-form.
Titans kemi
Titan er meget korrosionsbestandigt og er resistent overfor fortyndet svovlsyre og saltsyre og de fleste organiske syrer[2], men titan kan korroderes af koncentrerede syrer.[8] Rent titan opløses ikke i vand, men i koncentrerede syrer. Titan kan brænde; ved 610 °C reagerer det med ilten i den atmosfæriske luft og danner titandioxid, og ved 803 °C også med luftens kvælstof under dannelse af titannitrid.
Mekaniske egenskaber
Titan er velkendt for sin store styrke i forhold til vægten, og har desuden et relativt højt smeltepunkt; begge dele gør det til et velegnet materiale til krævende opgaver. Det er dertil meget formbart, navnlig i iltfrie omgivelser. Kommercielt tilgængeligt titan har en trækstyrke der kan måle sig med de stærkeste former for stål, men vejer 43 % mindre.
Tekniske anvendelser
Titan finder stigende anvendelse i en lang række forskellige produkter; ketsjere, golfkøller, cykler, camping-udstyr, armbåndsure, vielsesringe, laptop-computere og i mange forskellige former for laboratorieudstyr. Der findes også køkkengrej i titan, men da metallets termiske egenskaber kan føre til ujævn fordeling af varmen, er dette udstyr ikke lige velegnet til alle kulinariske formål.
Svejsede rør af titan bruges i den kemiske industri og på boreplatforme på grund af metallets korrosionsbestandighed. Metallets korrosionsbestandighed er udnyttet i aksler til skibsskruer, varmevekslere til afsaltningsanlæg, saltvands-akvarier, i ubåde og andre steder hvor metallet er i direkte kontakt med havvand.
Titan i og på kroppen
Titan irriterer ikke levende væv; tværtimod kan eksempelvis benvæv ligefrem "vokse sammen" med et implantat af dette metal. Da titan samtidig let lader sig farve ved anodisering, er det populært til smykker i piercinger, og bruges til at fremstille dyre, men robuste brillestel, som ikke generer huden.
Legeringer
Legeringer med titan har mange af titans "karaktertræk"; stor trækstyrke (selv ved høje temperaturer), lav vægt og stor modstandsdygtighed mod iltning ("rust"); derfor bruges disse legeringer til krævende opgaver i flyvemaskiner, pansring, krigsskibe, rumfartøjer og missiler. I stål og i aluminium-legeringer medvirker titan til at reducere materialets kornstørrelse. I stål fjerner titan endvidere ilt og, i rustfrit stål, også kulstof. Titan legeres også med kobber for at gøre dette hårdere, og med flere andre metaller, eksempelvis vanadium (denne legering bruges i stigende grad i flyvemaskiner; op mod 77 tons i et større moderne passagerfly), molybdæn og mangan.
Titandioxid
Langt det meste titan der bruges, indgår i titandioxid; et kridhvidt, bestandigt farvestof med god dækkeevne, som bruges i en lang række produkter, for eksempel maling, rettelak, papir, tandpasta og plastic. Titandioxid tilbagekaster også infrarødt og ultraviolet lys, og bruges derfor også i solcreme.
Andre anvendelser
Titan bruges i fyrværkeri der skal vise hvide effekter. Titantetraklorid, en farveløs væske, danner en tyk "røg" (tåge) i fugtig luft, og det udnyttes til røgslør og skywriting. Titan bruges som ydre beklædning på bygninger. I Moskva står der et 45 meter højt monument for Jurij Gagarin, udført i titan.
Forekomst
Titan er med 0,69 % det niende-mest udbredte grundstof i jordskorpen: Det findes aldrig i fri, metallisk form i naturen, men altid bundet i kemiske forbindelser med andre stoffer. Disse forbindelser findes i de fleste magmatiske bjergarter og i sedimenter af disse bjergarter, primært mineralerne anatas, brookit, ilmenit, perovskit, rutil, titanit og i mange jernmalme. Titanindholdet er meget jævnt fordelt over hele Jorden, så det er svært at finde forekomster med særlig højt indhold af titan. Af de mange forskellige titanholdige mineraler er det dog kun ilmenit og rutil der har betydning for den kommercielle udvinding af titan, og selv dem er det svært at finde store koncentrerede forekomster af. De mest betydelige forekomster ligger i Australien, New Zealand, Skandinavien, Nordamerika, Malaysia og i Kwale-regionen i Kenya.
Titan er også blevet påvist i meteoritter, og i Solen samt i stjerner af spektralklasse M, og prøver hentet fra Månen af astronauterne i Apollo 17 indeholder 12,1 % titandioxid.
Udvinding
Da titan reagerer med ilt ved høje temperaturer, kan man ikke som med andre metaller reducere oxidet med et andet metal, så til kommerciel fremstilling af titan benyttes Kroll-processen; en omstændelig og omkostningstung metode der blev udviklet i 1946 af William Justin Kroll: Først omdannes titandioxid til titantetraklorid, som fortættes og oprenses ved destillation. Til sidst reduceres kloridet til det rene metal ved hjælp af 800 °C varm, smeltet magnesium under en atmosfære af argon.
Den nyere, såkaldte FFC Cambridge-proces kan muligvis erstatte Kroll-processen: Denne reaktion tager udgangspunkt i titandioxid, og resulterer i titan i enten pulverform eller som et "svampet" stykke metal med en masse porer og åbninger i. Man håber at denne proces kan gøre titan meget billigere, og introducere materialet på områder, hvor man i dag bruger specielle aluminium-legeringer og ståltyper.
I 2013 blev en ny tretrinsproces udvindingsmetode opdaget.[9]
Historie
Titan blev opdaget i 1791 af amatør-geologen William Gregor fra Creed i Cornwall i England: Han fandt ud af at mineralet ilmenit indeholdt et hidtil ukendt grundstof, og kaldte det for menachite (alternativ stavemåde manaccanite) efter det nærliggende Manaccan sogn. Omtrent samtidig lykkedes det Franz Joseph Muller at isolere stoffet, men han formåede ikke at identificere det.
Uafhængigt af Gregor og Muller, men flere år senere, "genopdagede" tyskeren Martin Heinrich Klaproth stoffet, denne gang i mineralet rutil. Han bekræftede at der var tale om et "nyt" grundstof, og i 1795 navngav han det efter titanerne fra den græske mytologi.
Titan har altid været svært at udskille i ren form; først i 1910 lykkedes det Matthew A. Hunter at isolere 99,9 % rent titan ved at opvarme titantetraklorid med natrium i den såkaldte Hunter-proces. Først i 1946, da Kroll-processen blev opfundet, fandt titan anvendelse udenfor laboratoriet, og det er stadig denne proces der bruges i dag.
Isotoper af titan
Naturligt forekommende titan består af fem forskellige isotoper; 46Ti, 47Ti, 48Ti, 49Ti og 50Ti, hvoraf 48Ti er den mest udbredte isotop med 73,8 %. Hertil kender man 11 radioaktive isotoper, hvoraf 44Ti er den mest "sejlivede" med en halveringstid på 63 år — de øvrige titan-isotoper har halveringstider fra få timer og ned til under et halvt sekund.
Referencer
- ^ a b c "Titanium". Encyclopædia Britannica. 2006. Hentet 29. december 2006.
- ^ a b Lide, D. R., red. (2005). CRC Handbook of Chemistry and Physics (86th udgave). Boca Raton (FL): CRC Press. ISBN 0-8493-0486-5.
- ^ Krebs, Robert E. (2006). The History and Use of Our Earth's Chemical Elements: A Reference Guide (2nd udgave). Westport, CT: Greenwood Press. ISBN 978-0-313-33438-2.
- ^ Donachie 1988, s. 11
- ^ Barksdale 1968, s. 738
- ^ "Titanium". Columbia Encyclopedia (6th udgave). New York: Columbia University Press. 2000-2006. ISBN 978-0-7876-5015-5. Arkiveret fra originalen 18. november 2011.
- ^ Barbalace, Kenneth L. (2006). "Periodic Table of Elements: Ti – Titanium". Hentet 26. december 2006.
- ^ Casillas, N.; Charlebois, S.; Smyrl, W. H.; White, H. S. (1994). "Pitting Corrosion of Titanium". J. Electrochem. Soc. 141 (3): 636-642. doi:10.1149/1.2054783. ISSN 0013-4651.
- ^ 30. dec 2013, ing.dk: Ny metode kan reducere energiforbruget ved fremstilling af titan med 60 pct.
- Litteratur
- Barksdale, Jelks (1968). "Titanium". I Clifford A. Hampel (red.). The Encyclopedia of the Chemical Elements. New York: Reinhold Book Corporation. s. 732–738. LCCN 68029938.
{{cite book}}: CS1-vedligeholdelse: ref gentaget (link) - Donachie, Matthew J., Jr. (1988). TITANIUM: A Technical Guide. Metals Park, OH: ASM International. s. 11. ISBN 978-0-87170-309-5.
{{cite book}}: CS1-vedligeholdelse: ref gentaget (link) - Emsley, John (2001). "Titanium". Nature's Building Blocks: An A-Z Guide to the Elements. Oxford, England, UK: Oxford University Press. ISBN 978-0-19-850340-8.
{{cite book}}: CS1-vedligeholdelse: ref gentaget (link) - Flower, Harvey M. (2000). "Materials Science: A moving oxygen story". Nature. 407 (6802): 305-306. doi:10.1038/35030266. PMID 11014169.
- Greenwood, N. N.; Earnshaw, A. (1997). Chemistry of the Elements (2nd udgave). Oxford: Butterworth-Heinemann. ISBN 978-0-7506-3365-9.
- Roza, Greg (2008). Titanium (First udgave). New York, NY: The Rosen Publishing Group. ISBN 978-1-4042-1412-5.
{{cite book}}: CS1-vedligeholdelse: ref gentaget (link)
Eksterne henvisninger
Medier brugt på denne side
Forfatter/Opretter: Alchemist-hp (pse-mendelejew.de), Licens: CC BY-SA 3.0
A titanium crystal bar, high purity 99,995 %, made by the iodide process at URALREDMET in the Soviet era. Weight ≈283 g, ≈5.5 " long, ≈1 " diameter
(c) Peo at the Danish language Wikipedia, CC BY-SA 3.0
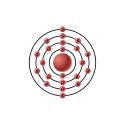
Denne tegning forestiller elektronkonfigurationen i et titaniumatom: Den store kugle i midten forestiller atomkernen, og de små kugler er elektronerne. Bogstaverne på elektron-kuglerne angiver hvilken orbital de tilhører. Den lyserøde farve markerer at titanium hører til overgangsmetallerne.