Testosteron

Testosteron er det mandlige kønshormon, som spiller en central rolle i udviklingen af maskuline karaktertræk. Kvinder har mindre mængde testosteron end mænd.
Hormoner er kemiske budbringere, der sender informationer fra de endokrine kirtler til de hormon-påvirkelige målceller. Hormon er græsk og betyder 'at vække', hvilket hentyder til at hormoner virker ved at stimulere cellernes processer.
Testosteron udskilles hos mænd primært af testiklerne og sendes derfra via blodbanen ud til resten af organismen. Hos kvinder produceres testosteron i æggestokkene og binyrerne.
Effekten af testosteron
Cirka 98% af alt testosteron der er i blodet er bundet til enten kønshormonbindende globulin (SHBG), som er et protein, der binder sig stærkt til testosteron og gør denne procentdel af kroppens testosteron virkningsløs, eller til albumin, som er blodplasmaproteiner.[1] Cirka 70% af alt kroppens testosteron er stærkt bundet til SHBG, og 20-30% er svagt bundet til albumin. Resten (mellem 1-4% af alt testosteron) er i fri form, og er i stand til at have maskuliniserende effekter på kroppen og hjernen ved at aktivere androgenreceptorer.
Effekt på udviklingen af kønskarakterer
Testosteron er ansvarlig for udviklingen af de ydre og de indre kønsorganer og for stimulering af hårvækst, stemmelejets udvikling og for udvikling af styrken af de seksuelle oplevelser hos både mænd og kvinder. Desuden påvirker testosteron udviklingen af skeletmuskler og fordeling af fedtlag. Testosteron påvirker ikke udviklingen af testiklerne, men hæmmer hjernens udskillelse af andre kønshormoner. For lavt testosteron kan derfor medføre forøget udskillelse af andre kønshormoner.
Effekt på sexlysten
Testosteron har betydelig indvirkning på seksuel funktion og mænd med et lavt niveau af testosteron har ofte manglende sexlyst.[2] Sexlysten og seksuel funktion bliver som regel forbedret når mænd med testosteronmangel (hypogonadisme) bliver behandlet med testosteron. Effekten af testosteron på seksuel funktion varierer i meget høj grad fra person til person, og er i høj grad påvirket af genetisk variation i androgenreceptorgenet hos mænd med normalt testosteronniveau, men ikke hos dem med et lavt testosteronniveau.[3]
Effekt på fingerlængderatioen
Mænd har i gennemsnit en markant længere ringfinger i forhold til pegefinger sammenlignet med kvinder. Der er tilsyneladende en sammenhæng mellem mængden af testosteron i livmoderen under fosterudviklingen og fingerlængdeforholdet.[4][5][6] Jo højere niveauet af testosteron er i forhold til østrogen i fostertilstanden, jo kortere vil pegefingeren være i forhold til ringfingeren. Forholdet mellem længden af ringfingeren i forhold til pegefingeren kaldes på engelsk for Digit Ratio, eller 2D4D Ratio, og værdien beregnes ved at dividere længden af pegefinderen med ringfingeren. Jo lavere tallet er, jo mere maskulin vil fingerlængden være. Mere maskuline fingerlængder har været forbundet med højere niveau af aggressivitet hos mænd, men ikke kvinder.[7] Mænd har i gennemsnit en fingerlængderatio på 0.947, med en standardafvigelse på 0.029 sammenlignet med 0.965 hos kvinder, med en standardafvigelse på 0.026.[8]. Jo lavere tallet er, jo mere maskulin vil fingerlængden også være.
Androgenreceptoren
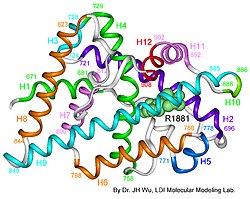
Testosteron virker primært ved at binde til og aktivere androgenreceptoren,[9] der er en såkaldt kernereceptor, der binder til DNA. Genet, der koder for androgenreceptoren, kontrollerer de fleste af testosterons effekter. Testosterons effekter på fx hjernen (seksuel funktion) og kroppen (især skæg og kropshårvækst) sker således gennem aktivering/stimulering af androgenreceptorer. Undtagelser er fx effekten af testosteron på knoglemassen, som sker efter omdannelsen af testosteron til østrogen - denne effekt sker igennem enzymet aromatase. Genet for androgenreceptoren er lokaliseret på X-kromosomet.
CAG repeats i androgenreceptorgenet
En region i androgenreceptorgenets DNA indeholder en række såkaldte CAG repeats, som er en repetitiv gentagelse af nukleotidsekvensen cytosin-adenin-guanin, der koder for aminosyren glutamin (forkortes Gln eller Q). Antallet af gentagelser, og dermed antallet af på hinanden følgende glutaminenheder i androgenreceptorproteinet, har vist sig at være omvendt proportionel med effekten af hvormed testosteron aktiverer androgenreceptoren.[10][11] Antallet af CAG repeats varierer hos normale mennesker mellem 9 og 37. Jo flere CAG repeats en person har, jo mindre er effekterne af testosteron på kroppen og hjernen, og omvendt - jo mindre antallet af CAG repeats en person har, jo mere massiv vil påvirkningen af testosteron være på kroppen og hjernen, givet et tilstrækkeligt niveau af testosteron.
Betydningen af CAG repeats for seksuel funktion
Effekten af testosteronbehandling på genoprettelsen af seksuel funktion hænger stærkt sammen med antallet af CAG repeats i androgenreceptorgenet.[12][13]. Andre studier indikerer at testosterons effekter på vækst af skæg og hår på kroppen hænger sammen med antallet af CAG repeats.[14][15]
Betydningen af CAG repeats for personlighedskarakteristika
Testosteron kan også have indflydelse på personligheden. Testosteron har således en effekt på impulsivitet, og sammenhængen mellem frit testosteron og motorisk impulsivitet er koblet til antallet af CAG repeats i androgenreceptorgenet.[16] Studier af betydningen af testosteron og CAG repeats for depression har givet varierende resultater.[17][18]
Biosyntese og kemisk syntese

Kemisk set er testosteron et steroid med sumformlen C19H28O2 og de systematiske navne 17β-hydroxyandrost-4-en-3-on og 4-androsten-17β-ol-3-on. Biosyntesen foregår i Leydig-cellerne ud fra cholesterol, der ad to synteseveje omdannes til testosteron. Det sidste trin, reduktionen af androstendion, bliver katalyseret af enzymet testosteron-17beta-dehydrogenase.
Den kemiske syntese blev i 1935 foretaget uafhængigt af Butenant og Ruzicka, der fik Nobelprisen i kemi i 1939.
Doping
Testosteron og utallige derivater af testosteron anvendes som dopingmidler til præstationsfremmende formål af bodybuildere og sportsudøvere og kendes under betegnelsen AAS, anabole androgene steroider. For eksempel er Omnandren et kombinationsstof af fire testosteron-baserede stoffer: testosteron-propionat, testosteron-phenylpropionate, testosteron-isocaproate og testosteron-decanoate, der er vidt udbredt som dopingmiddel.[19][20] En lang række bivirkninger følger efter anvendelsen af anabole steroider lige fra cancer i lever og nyrer over forhøjet blodtryk til psykiske lidelser.[21][22][23]
Se også
| Søsterprojekter med yderligere information: |
- Kernereceptor
- Oxandrolon
- Deca Durabolin
- Dianabol
- Stanozolol
- Winstrol
Eksterne henvisninger
- ^ Rosner W, Hryb DJ, Kahn SM, Nakhla AM, Romas NA (2010) Interactions of sex hormone-binding globulin with target cells. Molecular and Cellular Endocrinology 316: 79-85. doi: 10.1016/j.mce.2009.08.009.
- ^ Bancroft J (2005) The endocrinology of sexual arousal. Journal of Endocrinology 186: 411-27. doi: 10.1677/joe.1.06233.
- ^ Tirabassi G, Corona G, Falzetti S, Delli Muti N, Maggi M, Balercia G (2016) Influence of Androgen Receptor Gene CAG and GGC Polymorphisms on Male Sexual Function: A Cross-Sectional Study. International Journal of Endocrinology. 2016: 5083569. doi: 10.1155/2016/5083569.
- ^ Lutchmaya S, Baron-Cohen S, Raggatt P, Knickmeyer R, Manning JT (2004) 2nd to 4th digit ratios, fetal testosterone and estradiol. Early Human Development 77: 23-8. doi: 10.1016/j.earlhumdev.2003.12.002.
- ^ Zheng, Zhengui; Cohn, Martin J. (2011-09-27). "Developmental basis of sexually dimorphic digit ratios". Proceedings of the National Academy of Sciences. 108 (39): 16289-16294. doi:10.1073/pnas.1108312108. ISSN 0027-8424. PMC 3182741. PMID 21896736. Arkiveret fra originalen 20. november 2017. Hentet 5. oktober 2017.
- ^ Hönekopp, Johannes; Bartholdt, Luise; Beier, Lothar; Liebert, Andreas (2007-01-01). "Second to fourth digit length ratio (2D:4D) and adult sex hormone levels: New data and a meta-analytic review". Psychoneuroendocrinology. 32 (4): 313-21. doi:10.1016/j.psyneuen.2007.01.007. ISSN 0306-4530. PMID 17400395.
- ^ Bailey AA, Hurd PL (2005) Finger length ratio (2D:4D) correlates with physical aggression in men but not in women. Biological Psychology 68: 215-22. doi: 10.1016/j.biopsycho.2004.05.001.
- ^ Digit ratio
- ^ Matsumoto T, Sakari M, Okada M, Yokoyama A, Takahashi S, Kouzmenko A, Kato S (2013) The androgen receptor in health and disease. Arkiveret 6. oktober 2021 hos Wayback Machine Annual Review of Physiology 75: 201-24. doi: 10.1146/annurev-physiol-030212-183656.
- ^ Chamberlain NL, Driver ED, Miesfeld RL (1994) The length and location of CAG trinucleotide repeats in the androgen receptor N-terminal domain affect transactivation function. Nucleic Acids Research 22: 3181-6. doi: 10.1093/nar/22.15.3181
- ^ Beilin J, Ball EM, Favaloro JM, Zajac JD. Effect of the androgen receptor CAG repeat polymorphism on transcriptional activity: specificity in prostate and non-prostate cell lines. Journal of Molecular Endocrinology 25: 85–96. doi: 10.1677/jme.0.0250085
- ^ Tirabassi G, Delli Muti N, Corona G, Maggi M, Balercia G (2014) Androgen receptor gene CAG repeat polymorphism independently influences recovery of male sexual function after testosterone replacement therapy in postsurgical hypogonadotropic hypogonadism. The Journal of Sexual Medicine 11: 1302-8. doi: 10.1111/jsm.12493
- ^ Tirabassi G, Corona G, Biagioli A, Buldreghini E, delli Muti N, Maggi M, Balercia G (2015) Influence of androgen receptor CAG polymorphism on sexual function recovery after testosterone therapy in late-onset hypogonadism. The Journal of Sexual Medicine 12: 381-8. doi: 10.1111/jsm.12790
- ^ og Härkönen K, Huhtaniemi I, Mäkinen J, Hübler D, Irjala K, Koskenvuo M, Oettel M, Raitakari O, Saad F, Pöllänen P (2003) The polymorphic androgen receptor gene CAG repeat, pituitary-testicular function and andropausal symptoms in ageing men. International Journal of Andrology 26: 187-94. doi: 10.1046/j.1365-2605.2003.00415.x
- ^ Dhiman P, Bhansali A, Prasad R, Dutta P, Walia R, Ravikiran M (2011) Predictors of pilosebaceous unit responsiveness to testosterone therapy in patients with hypogonadotrophic hypogonadism. Andrologia 43: 422-7. doi: 10.1111/j.1439-0272.2010.01093.x
- ^ Aluja A, García LF, Martí-Guiu M, Blanco E, García O, Fibla J, Blanch À (2015) Interactions among impulsiveness, testosterone, sex hormone binding globulin and androgen receptor gene CAG repeat length. Physiology & Behavior 147: 91-6. doi: 10.1016/j.physbeh.2015.04.022.
- ^ Seidman SN, Araujo AB, Roose SP, McKinlay JB (2001) Testosterone level, androgen receptor polymorphism, and depressive symptoms in middle-aged men. Biological Psychiatry 50: 371-6. doi: 10.1016/s0006-3223(01)01148-9.
- ^ Colangelo LA, Sharp L, Kopp P, Scholtens D, Chiu BC, Liu K, Gapstur SM (2007) Total testosterone, androgen receptor polymorphism, and depressive symptoms in young black and white men: the CARDIA Male Hormone Study. Psychoneuroendocrinology 32: 951-8. doi: 10.1016/j.psyneuen.2007.06.014.
- ^ "Anabole steroider. Anti Doping Danmark". Arkiveret fra originalen 1. september 2012. Hentet 13. december 2012.
- ^ "Mænd og testosteron. Helsenyt". Arkiveret fra originalen 7. marts 2013. Hentet 13. december 2012.
- ^ Bivirkninger af steroider. Netdoktor.dk
- ^ Anabolske steroiders bivirkninger. Bodylab.dk
- ^ Bivirkninger ved steroider. Steroider.dk (Webside ikke længere tilgængelig)
Eksterne kilder
| Spire Denne artikel om lægevidenskab er en spire som bør udbygges. Du er velkommen til at hjælpe Wikipedia ved at udvide den. |
Medier brugt på denne side
Forfatter/Opretter:
David Richfield (Slashme) and Mikael Häggström. Derived from previous version by Hoffmeier and Settersr.
In external use, this diagram may be cited as:
- (2014). "Diagram of the pathways of human steroidogenesis". WikiJournal of Medicine 1 (1). DOI:10.15347/wjm/2014.005. ISSN 20018762.
*Enzymes, their cellular location, substrates and products in human steroidogenesis.
Shown also is the major classes of steroid hormones: progestagens, mineralocorticoids, glucocorticoids, androgens and estrogens. However, they partly overlap, e.g. mineralocorticoids and glucocorticoids.
- White circles indicate changes in molecular structure compared with precursors. For more information on interpretation of molecular structures, see structural formula.
- Arrows are shown as unidirectional to indicate the usual net directions, but technically all biochemical reactions are considered bidirectional.
HSD: Hydroxysteroid dehydrogenase
References:
- Boron WF, Boulpaep EL (2003) Medical Physiology: A Cellular And Molecular Approach, Elsevier/Saunders, pp. page 1,300 ISBN: 1-4160-2328-3.
- For the absence of conversion of corticosterone to cortisol: Steroid hormone biosynthesis Reference pathway (KO). KEGG: Kyoto Encyclopedia of Genes and Genomes. Kyoto University Bioinformatics Center. (1 November 2013).
- There is no appreciable conversion of corticosterone to cortisol in the adrenal cortex as 21-OH steroids are poor substrates for 17-alpha hydroxylase.
Further reading:
- Hanukoglu I (1992). "Steroidogenic enzymes: structure, function, and role in regulation of steroid hormone biosynthesis". The Journal of Steroid Biochemistry and Molecular Biology 43 (8): 779–804. DOI:10.1016/0960-0760(92)90307-5. PMID 22217824.
- Payne AH, Hales DB (2004). "Overview of steroidogenic enzymes in the pathway from cholesterol to active steroid hormones". Endocrine Reviews 25 (6): 947–70. DOI:10.1210/er.2003-0030. PMID 15583024.
See also:
Forfatter/Opretter: Prof. JH Wu McGill University Lady Davis Institute, Licens: CC BY 3.0
3-D model of the human androgen receptor protein.
Forfatter/Opretter: Anomie, Licens: LGPL
Red plus symbol in a circle, based on Image:Nuvola apps kcmdrkonqi.png
Structural diagram of metandienone (INN), also known as methandrostenolone. Created using ACD/ChemSketch 8.0 and Inkscape.
Structure of testosterone




