Termisk ligevægt
 Ikke at forveksle med termodynamisk ligevægt. Et system i termodynamisk ligevægt er også i termisk ligevægt, men det modsatte er ikke nødvendigvis tilfældes.
Ikke at forveksle med termodynamisk ligevægt. Et system i termodynamisk ligevægt er også i termisk ligevægt, men det modsatte er ikke nødvendigvis tilfældes.
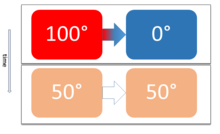
Termisk ligevægt opstår, når to eller flere legemer kan udveksle energi kaldet varme. De to legemer vil udveksle energi, indtil begge har samme temperatur.
Det varme legeme afgiver energi, mens det kolde legeme tager imod energi. Når ligevægten er opnået, er den samlede energiudveksling nul.
Et simpelt hverdagseksempel er en kop friskbrygget kaffe, der står i en stue. Mens kaffen er 80 °C, er stuen 20 °C, og de to systemer er derfor ikke i termisk ligevægt. Efter noget tid er kaffen kølet til at have samme temperatur som stuen, og der er således termisk ligevægt.
Statistisk oprindelse
Termisk ligevægt kan forstås vha. den statistiske mekanik ved at betragte to systemer 1 og 2. For et system med energien kan der være flere forskellige mulige tilstande - såkaldte mikrotilstande - som har den samme energi. Dette antal kan kaldes for for system 1. Systemet sættes nu i termisk kontakt med et system, der har energien samt antal mikrotilstande. For hver mikrotilstande i system 1 er der altså mikrotilstande i system 2. Antallet af mikrotilstande i det samlede system er derfor produktet:
Når disse to systemer er i termisk kontakt, kan og ændre sig, men den samlede energi forbliver konstant:
Under antagelsen at alle mikrotilstande er lige sandsynlige, vil energiudvekslingen betyde, at det er mest sandsynligt, at det samlede system har en energifordeling - en makrotilstand - der maksimerer .
Ved maksimum er den afledte med hensyn til energien nul, så det skal derfor gælde, at
Dette er altså den statistiske betingelse for termisk ligevægt.
Udtrykket evalueres:
Da den samlede energi er uændret
er den afledte af system 2's energi mht. system 1:
Dette indsættes, hvorefter og separeres:
Da den afledte af den naturlige logaritme er
kan udtrykket skrives som:
Den afledte af logaritmen til antallet af mikrotilstande mht. energi skal altså være den samme for begge systemer, hvis de har opnået termisk ligevægt.
Som nævnt i indledning er der termisk ligevægt, når temperaturerne er ens, så denne lighed kan bruges til at lave en statistisk definition af temperatur. Da differentialkvotienten har enheder af invers energi, er temperatur defineret som
hvor er Boltzmanns konstant. Jo hurtigere antallet af mikrotilstande ændrer sig med hensyn til energien, jo mindre er temperaturen.[1]
Kildehenvisninger
- ^ Blundell, Stephen J.; Blundell, Katherine M. (2006). "4 Temperature and the Boltzmann factor". Concepts in Thermal Physics (engelsk) (1. udgave). Oxford University Press. p. 33-36. ISBN 978-0-19-856770-7.
Medier brugt på denne side
Forfatter/Opretter: Kku, Licens: CC BY-SA 4.0
Development of a thermal equilibrium in a closed system