Tantal
| Tantal | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 Gråblåt metal | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Periodiske system | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Generelt | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomtegn | Ta | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomnummer | 73 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
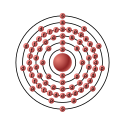
| Elektronkonfiguration | 2, 8, 18, 32, 11, 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gruppe | 5 (Overgangsmetal) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Periode | 6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Blok | d | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS-nummer | 7440-25-7 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomare egenskaber | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atommasse | 180.94788 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kovalent radius | 138 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronkonfiguration | [Xe] 4f14 5d3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektroner i hver skal | 2, 8, 18, 32, 11, 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kemiske egenskaber | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidationstrin | 5, 4, 3 (svagt surt oxid) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronegativitet | 1,5 (Paulings skala) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fysiske egenskaber | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tilstandsform | Fast | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Krystalstruktur | Kubisk rumcentreret | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Massefylde (fast stof) | 16,69 g/cm3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Massefylde (væske) | 15 g/cm3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Smeltepunkt | 3290K / 3017 °C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kogepunkt | 5731K / 5458 °C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Smeltevarme | 36,57 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fordampningsvarme | 732,8 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Varmefylde | (25°C) 25,36 J·mol–1K–1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Varmeledningsevne | (300K) 57,5 W·m–1K–1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Varmeudvidelseskoeff. | (25°C) 6,3 μm/m·K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektrisk resistivitet | 131 nΩ·m | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetiske egenskaber | Ikke oplyst | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mekaniske egenskaber | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Youngs modul | 186 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Forskydningsmodul | 69 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kompressibilitetsmodul | 200 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Poissons forhold | 0,35 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Hårdhed (Mohs' skala) | 6,5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Hårdhed (Vickers) | 873 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Hårdhed (Brinell) | 800 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Tantal (efter Tantalos fra den græske mytologi) er det 73. grundstof i det periodiske system, og har det kemiske symbol Ta: Under normale tryk- og temperaturforhold optræder dette overgangsmetal som et mørkt, hårdt og korrosionsbestandigt metal.
Egenskaber
Selvom tantal er hårdt, er det samtidig formbart. Det er en fremragende elektrisk leder og varmeleder, og dertil er det særdeles varmebestandigt; smeltepunktet på 3017° C overgås kun af wolfram, rhenium og kulstof.
Tantal er berømt for sin modstandsdygtighed overfor korrosion: Ved temperaturer under 150 grader Celsius angribes tantal ikke engang af det ellers meget aggressive kongevand. Til gengæld kan kaliumhydroxid, flussyre samt sure opløsninger med svovltrioxid og fluor-ioner angribe metallet.
Tekniske anvendelser
Tantal bruges primært indenfor elektronikken, i elektroniske komponenter som modstande af høj kvalitet, og især i tantalelektrolytkondensatorer; specielle kondensatorer med særlig stor elektrisk kapacitet i forhold til deres størrelse: Disse kondensatorer udnytter det samme princip som i "normale" elektrolytkondensatorer baseret på aluminium, men da tantal danner et meget tyndere oxidlag end aluminium, kan tantalkondensatorerne gøres markant mindre end tilsvarende "almindelige" elektrolytkondensatorer.
Tantal indgår i en række legeringer som har høje smeltepunkter, er hårde men alligevel formbare. Disse legeringer bruges til krævende opgaver som skærende værktøjer til bearbejdning af andre metaller, visse komponenter i jetmotorer samt komponenter til nuklear og kemisk industri.
Ud over at være modstandsdygtigt også overfor kropsvæsker, irriterer metallet ikke levende væv: Af den grund bruger man ofte metallet i kirurgiske instrumenter og implantater.
Tantaloxid er gennemsigtigt og har et højt brydningsindeks, hvilket udnyttes i specielle linser til kameraers optik.
Forskere ved Los Alamos National Laboratory har udviklet et komposit af tantalkarbid og grafit, som er et af de hårdeste materialer der nogensinde er fremstillet. Koreanske forskere har udviklet et amorft materiale af tantal, wolfram og kobber der er mere elastiske og to til tre gange stærkere end almindelige stållegeringer.
Forekomst og udvinding
Tantal forekommer primært i mineralerne tantalit [(Fe, Mn) Ta2O6], microlit og euxenit, men findes også i andre mineraler, herunder samarskit og fergusonit. Disse råstoffer udvindes ved minedrift i Etiopien, Australien, Brasilien, Ægypten, Canada, den Demokratiske Republik Congo, Mozambique, Nigeria, Namibia, Portugal, Malaysia og Thailand.
Tantalit findes oftest blandet med columbit i en art malm kaldet coltan. Udvindingen af dette råstof i Congo har ført til etiske spørgsmål omkring varetagelsen af menneskerettighederne og truede dyrearter i området.
Adskillelsen af tantal fra niobium er kompliceret og kræver talrige bearbejdningstrin. Der er flere forskellige økonomisk rentable fremgangsmåder, herunder elektrolyse af smeltet kaliumfluortantalat med natrium, eller ved en reaktion mellem tantalkarbid og tantaloxid. Desuden udvindes tantal også som et biprodukt ved smeltning af tin.
Historie
Tantal blev første gang påvist i 1802 af den svenske kemiker Anders Ekeberg, og første gang isoleret af Ekebergs landsmand og fagfælle, Jöns Jakob Berzelius. De første prøver af det nye grundstof var dog ikke særlig rene, og mange af samtidens kemikere mente at det som svenskerne havde fundet var niobium – først da man midt i det 19. århundrede kunne demonstrere forskellene på syrer af de to metaller blev de sidste skeptikere overbevist.
Først i 1903, mere end et århundrede efter Ekebergs opdagelse, lykkedes det at fremstille tantal der var rent og formbart nok til at lave tynde tråde af metallet: De blev anvendt i glødelamper, indtil wolfram overtog den rolle.
Tantal har navn efter Tantalos fra den græske mytologi; ligesom Tantalos blev lokket med vand og frugt der veg tilbage hver gang han rakte eller bøjede sig efter det, synes dette nye grundstof at have "drillet" videnskaben så længe.
Isotoper af tantal
Naturligt forekommende tantal består af to isotoper: 181Ta, som er stabil, og den nukleare isomer 180mTa med en halveringstid på 1015 år. Den tilsvarende isotop i grundtilstanden, 180Ta, har til gengæld en ganske kort halveringstid; blot 8 timer.
Isotopen 181Ta har været foreslået som "ingrediens" i kernevåben, med de samme formål som kobolt i koboltbomben; at forøge den strålingen fra det resulterende radioaktive nedfald. Så vidt vides har ingen dog bygget et sådant våben.
Medier brugt på denne side
(c) Peo at the Danish language Wikipedia, CC BY-SA 3.0
Denne tegning forestiller elektronkonfigurationen i et tantalatom: Den store kugle i midten forestiller atomkernen, og de små kugler er elektronerne. Bogstaverne på elektron-kuglerne angiver hvilken orbital de tilhører. Den lyserøde farve markerer at tantal hører til overgangsmetallerne.