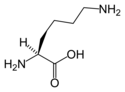
Standardaminosyre
Proteinogene aminosyrer, også kendt som normale, primære eller standardaminosyrer, omfatter de 20 aminosyrer, der indgår i proteiner i levende celler, og som kan afkodes via den genetiske kode. Denne artikel lister detaljer for disse aminosyrer, hvad angår kemisk struktur og egenskaber.
Strukturer
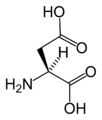
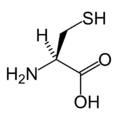
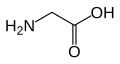
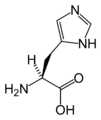
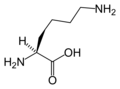
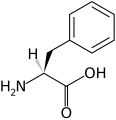
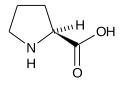
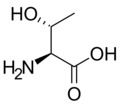
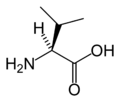
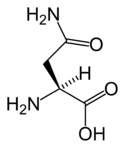
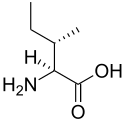
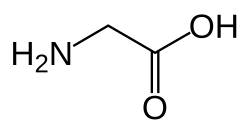
Strukturer og symboler for de 20 aminosyrer, der direkte kodes for ved proteinsyntese af den genetiske kode. Strukturen af en aminosyre og dens funktionelle grupper har stor betydning for dens virkning i proteiner.
- L-Alanin
(Ala / A) - L-Arginin
(Arg / R) - L-Asparagin
(Asn / N) - L-Asparaginsyre
(Asp / D) - L-Cystein
(Cys / C) - L-Glutaminsyre
(Glu / E) - L-Glutamin
(Gln / Q) - Glycin
(Gly / G) - L-Histidin
(His / H) - L-Isoleucin
(Ile / I) - L-Leucin
(Leu / L) - L-Lysin
(Lys / K) - L-Methionin
(Met / M) - L
(Phe / F) - L-Prolin
(Pro / P) - L-Serin
(Ser / S) - L-Threonin
(Thr / T) - L-Tryptophan
(Trp / W) - L-Tyrosin
(Tyr / Y) - L-Valin
(Val / V)
Kemiske egenskaber
Det følgende er en tabel, der lister et- og tre-bogstavsforkortelser samt kemiske egenskaber for standardaminosyrernes sidekæder. De listede masser er baseret på vægtgennemsnit for de enkelte elementers isotoper, som de er naturligt forekomne. Bemærk at ved dannelsen af en peptidbinding elimineres et vandmolekyle, således at en aminosyres masse i en proteinkæde reduceres med 18,01524 Da. Et-bogstavsforkortelsen for en ubestemt aminosyre er X. Trebogstavsforkortelsen Asx og et-bogstavsforkortelsen B betyder, at den omtalte aminosyre er enten asparagin eller asparaginsyre; Glx og Z betyder enten glutaminsyre eller glutamin; og Xle og J betyder enten leucin eller isoleucin. IUPAC/IUBMB anbefaler nu også at Sec og U refererer til selenocystein, mens Pyl og O refererer til pyrrolysin.
Generelle kemiske egenskaber
| Aminosyre | Kort | Forkortelse | Gennemsnitsmasse (Da) | pI | pK1 (α-COOH) | pK2 (α-+NH3) |
|---|---|---|---|---|---|---|
| Alanin | A | Ala | 89,09404 | 6,01 | 2,35 | 9,87 |
| Cystein | C | Cys | 121,15404 | 5,05 | 1,92 | 10,70 |
| Asparaginsyre | D | Asp | 133,10384 | 2,85 | 1,99 | 9,90 |
| Glutaminsyre | E | Glu | 147,13074 | 3,15 | 2,10 | 9,47 |
| Fenylalanin | F | Phe | 165,19184 | 5,49 | 2,20 | 9,31 |
| Glycin | G | Gly | 75,06714 | 6,06 | 2,35 | 9,78 |
| Histidin | H | His | 155,15634 | 7,60 | 1,80 | 9,33 |
| Isoleucin | I | Ile | 131,17464 | 6,05 | 2,32 | 9,76 |
| Lysin | K | Lys | 146,18934 | 9,60 | 2,16 | 9,06 |
| Leucin | L | Leu | 131,17464 | 6,01 | 2,33 | 9,74 |
| Methionin | M | Met | 149,20784 | 5,74 | 2,13 | 9,28 |
| Asparagin | N | Asn | 132,11904 | 5,41 | 2,14 | 8,72 |
| Prolin | P | Pro | 115,13194 | 6,30 | 1,95 | 10,64 |
| Glutamin | Q | Gln | 146,14594 | 5,65 | 2,17 | 9,13 |
| Arginin | R | Arg | 174,20274 | 10,76 | 1,82 | 8,99 |
| Serin | S | Ser | 105,09344 | 5,68 | 2,19 | 9,21 |
| Threonin | T | Thr | 119,12034 | 5,60 | 2,09 | 9,10 |
| Selenocystein | U | Sec | 169,06 | |||
| Valin | V | Val | 117,14784 | 6,00 | 2,39 | 9,74 |
| Tryptofan | W | Trp | 204,22844 | 5,89 | 2,46 | 9,41 |
| Tyrosin | Y | Tyr | 181,19124 | 5,64 | 2,20 | 9,21 |
Sidekædeegenskaber
| Aminosyre | Kort | Forkortelse | Sidekæde | Hydro- fobisk | pKa | Polær | pH | Lille | Meget lille | Aromatisk eller alifatisk | van der Waals volumen |
|---|---|---|---|---|---|---|---|---|---|---|---|
| Alanin | A | Ala | -CH3 | X | - | - | - | X | X | - | 67 |
| Cystein | C | Cys | -CH2SH | - | 8,18 | - | sur | X | - | - | 86 |
| Asparaginsyre | D | Asp | -CH2COOH | - | 3,90 | X | sur | X | - | - | 91 |
| Glutaminsyre | E | Glu | -CH2CH2COOH | - | 4,07 | X | sur | - | - | - | 109 |
| Fenylalanin | F | Phe | -CH2C6H5 | X | - | - | - | - | - | Aromatisk | 135 |
| Glycin | G | Gly | -H | - | - | - | - | X | X | - | 48 |
| Histidin | H | His | -CH2-C3H3N2 | - | 6,04 | X | svagt basisk | - | - | Aromatisk | 118 |
| Isoleucin | I | Ile | -CH(CH3)CH2CH3 | X | - | - | - | - | - | Alifatisk | 124 |
| Lysin | K | Lys | -(CH2)4NH2 | - | 10,54 | X | basisk | - | - | - | 135 |
| Leucin | L | Leu | -CH2CH(CH3)2 | X | - | - | - | - | - | Alifatisk | 124 |
| Methionin | M | Met | -CH2CH2SCH3 | X | - | - | - | - | - | - | 124 |
| Asparagin | N | Asn | -CH2CONH2 | - | - | X | - | X | - | - | 96 |
| Prolin | P | Pro | -CH2CH2CH2- | X | - | - | - | X | - | - | 90 |
| Glutamin | Q | Gln | -CH2CH2CONH2 | - | - | X | - | - | - | - | 114 |
| Arginin | R | Arg | -(CH2)3NH-C(NH)NH2 | - | 12,48 | X | stærkt basisk | - | - | - | 148 |
| Serin | S | Ser | -CH2OH | - | - | X | - | X | X | - | 73 |
| Threonin | T | Thr | -CH(OH)CH3 | - | - | X | svagt sur | X | - | - | 93 |
| Selenocystein | U | Sec | -CH2SeH | X | 5,73 | - | - | X | - | - | |
| Valin | V | Val | -CH(CH3)2 | X | - | - | - | X | - | Alifatisk | 105 |
| Tryptofan | W | Trp | -CH2C8H6N | X | - | - | - | - | - | Aromatisk | 163 |
| Tyrosin | Y | Tyr | -CH2-C6H4OH | - | 10,46 | X | - | - | - | Aromatisk | 141 |
Note: pKa-værdier for en aminosyre er typisk en anelse forskellige, når den befinder sig i forskellige miljøer for eksempel på overfladen og inde i et protein. Protein-pKa-beregning bruges nogle gange til at beregne ændringen i pKa-værdien i en sådan situation.
Genudtrykkelse og biokemi
| Aminosyre | Kort | Forkortelse | Kode(r) | Forekomst i proteiner (%) | Essentiel*** i mennesker |
|---|---|---|---|---|---|
| Alanin | A | Ala | GCU, GCC, GCA, GCG | 7,8 | - |
| Cystein | C | Cys | UGU, UGC | 1,9 | Betinget |
| Asparaginsyre | D | Asp | GAU, GAC | 5,3 | - |
| Glutamat | E | Glu | GAA, GAG | 6,3 | Betinget |
| Fenylalanin | F | Phe | UUU, UUC | 3,9 | Ja |
| Glycin | G | Gly | GGU, GGC, GGA, GGG | 7,2 | Betinget |
| Histidin | H | His | CAU, CAC | 2,3 | Ja |
| Isoleucin | I | Ile | AUU, AUC, AUA | 5,3 | Ja |
| Lysin | K | Lys | AAA, AAG | 5,9 | Ja |
| Leucin | L | Leu | UUA, UUG, CUU, CUC, CUA, CUG | 9,1 | Ja |
| Methionin | M | Met | AUG | 2,3 | Ja |
| Asparagin | N | Asn | AAU, AAC | 4,3 | - |
| Prolin | P | Pro | CCU, CCC, CCA, CCG | 5,2 | - |
| Glutamin | Q | Gln | CAA, CAG | 4,2 | - |
| Arginin | R | Arg | CGU, CGC, CGA, CGG, AGA, AGG | 5,1 | Betinget |
| Serin | S | Ser | UCU, UCC, UCA, UCG, AGU, AGC | 6,8 | - |
| Threonin | T | Thr | ACU, ACC, ACA, ACG | 5,9 | Ja |
| Selenocystein | U | Sec | UGA* | - | |
| Valin | V | Val | GUU, GUC, GUA, GUG | 6,6 | Ja |
| Tryptofan | W | Trp | UGG | 1,4 | Ja |
| Tyrosin | Y | Tyr | UAU, UAC | 3,2 | Betinget |
| Stopkode** | - | Term | UAA, UAG, UGA | - | - |
* UGA er normalt en stopkode, men koder dog for selenocystein, hvis et SECIS-element er til stede.
** Stopkoden er ikke en aminosyre, men er inkluderet for at opnå en komplet oversigt.
*** Mennesker kan ikke syntetisere en essentiel aminosyre og disse må derfor suppleres gennem diæt. Betingede essentielle aminosyrer er ikke normalt nødvendige at få tilført gennem diæt, men må dog suppleres i specifikke populationer, der ikke syntetiserer dem i tilstrækkelig mængde.
Bemærkninger
| Aminosyre | Forkortelse | Bemærkninger | |
|---|---|---|---|
| Alanin | A | Ala | Forefindes i rigelige mængder, meget alsidig. Mere stiv end glycin, men lille nok til kun at skabe små steriske grænser for proteinkonformation. Den opfører sig ganske neutralt og kan befinde sig i både hydrofile og hydrofobe regioner af proteiner. |
| Cystein | C | Cys | Svovlatomet binder let til tungmetalioner. Under oxiderende betingelser kan to cysteinmolekyler bindes sammen med en disulfidbinding og danne aminosyren cystin. Når cysteiner er en del af proteiner, stabiliserer de den tertiære struktur og gør proteinet mere resistent over for denaturering; disulfidbroer er derfor almindelige i proteiner, der skal fungere i barske miljøer, inklusiv fordøjelsesenzymer (fx pepsin og chymotrypsin) og strukturproteiner (fx keratin). Disulfider findes også i peptider, der er for små til at bibeholde deres stabile form selv (fx insulin). Hvis disulfidbroer brydes, kan de gendannes under de rette betingelser. |
| Asparaginsyre | D | Asp | Opfører sig som glutaminsyre. Bærer en hydrofil syregruppe med stærk negativ ladning. Befinder sig normalt på ydersiden af proteiner, hvor det medvirker til vandopløseligheden. Binder til positivt ladede molekyler og ioner, er ofte brugt i enzymer til at binde metalioner. Når de befinder sig inde i proteiner er glutamat og aspartat ofte parrede med arginin og lysin. |
| Glutaminsyre | E | Glu | Opfører sig som asparaginsyre. Har længere og lidt mere fleksibel sidekæde. |
| Fenylalanin | F | Phe | Essentiel for mennesker. Fenylalanin, tyrosin og tryptophan har store stive aromatiske grupper som sidekæder. Disse er de største aminosyrer. Ligesom isoleucin, leucin og valin er disse hydrofobe og har tendens til at befinde sig på indersiden af foldede proteiner, eller på ydersiden af membranproteiner. I membranproteiner ses det ofte at der sidder aromatiskeaminosyrer i grænsefladen mellem membranens hydrofile og hydrofobe lag. |
| Glycin | G | Gly | På grund af de to brintatomer ved α-kulstofatomet, er glycin ikke optisk aktiv. Den er den mindste aminosyre, roterer let og tilføjer fleksibilitet til proteinkæder. Den kan passe ind på de mest snævre rum, for eksempel en trippelhelix i collagen. Da for meget fleksibilitet ofte ikke er ønskværdigt er glycin mindre almindelig end alanin som strukturelt element. |
| Histidin | H | His | Ved selv svagt sure betingelser sker protonering af nitrogenet, hvilket ændrer egenskaberne for histidin og polipeptidet som et hele. Den bruges i mange proteiner som regulerende mekanisme, der ændrer konformationen og adfærden for polypeptidet i sure regioner såsom det sene endosom og lysosomer, hvor konformationsændringer i enzymer gennemtvinges. Histidin forekommer dog ikke i så store mængder, idet kun små mængder behøves for den omtalte virkning. |
| Isoleucin | I | Ile | Essentiel for mennesker. Isoleucin, leucin og valin har store alifatiske hydrofobe sidekæder. Molekylerne er stive, og deres samlede hydrofobe interaktioner er vigtige for korrekt foldning af proteiner, da disse kæder har tendens til at befinde sig inde i et vandopløseligt protein eller på ydersiden af membranproteiner. |
| Lysin | K | Lys | Essentiel for mennesker. Opfører sig som arginin. Indeholder en lang fleksibel sidekæde med en positivt ladet ende. Fleksibiliteten af kæden gør lysin og arginin passende til at binde til molekyler med mange nagative ladninger på overfladen, fx er DNA-bindende proteiner rige på argininer og lysiner i deres aktive regioner. Den stærke ladning gør disse to aminosyrer egnede til beliggenhed i de ydre hydrofile overflader af proteiner: når de findes indenfor er de primært parrede med ligeledes negativt ladede aminosyrer som aspartat eller glutamat. |
| Leucin | L | Leu | Essentiel for mennesker. Opfører sig som isoleucin og valin. Se isoleucin. |
| Methionin | M | Met | Essentiel for mennesker. Altid den første aminosyre, der indbygges i et protein; nogle gange dog fjernet efter translation. Som cystein indeholder den svovl, men med en methylgruppe i stedet for hydrogen. Denne methylgruppe kan aktiveres og bruges i mange reaktioner, hvor et nyt carbonatom tilføjes til et andet molekyle. |
| Asparagin | N | Asn | Ligner asparaginsyre. Asn indeholder en amidgruppe hvor Asp har en carboxylgruppe. |
| Prolin | P | Pro | Indeholder en usædvanlig ring fra alfa-kulstofatomet til N-terminalen, hvilket tvinger CO-NH-sekvensen til at have en fast konformation. Kan heraf afbryde proteinstrukurer som α-helicer og β-sheets. Forekommer meget i collagen, hvor den ofte undergår en posttranslationel modifikation til hydroxyprolin. Forekommer ellers ikke hyppigt. |
| Glutamin | Q | Gln | Ligner glutaminsyre. Gln indeholder en amidgruppe hvor Glu har en carboxylgruppe. Bruges i proteiner og som ammoniaklager. |
| Arginin | R | Arg | Funktionsmæssig lignende lysin. |
| Serin | S | Ser | Serin og threonin har en kort gruppe, som ender med en hydroxylgruppe. Pga. det meget elektonegativeiltatom i sidekæderne virker serin og threonin ofte som hydrogendonorer i enzymer. Begge er meget hydrofile og ydre overfladeregioner i vandopløselige proteiner er derfor ofte rige på disse to. |
| Threonin | T | Thr | Essentiel for mennesker. Opfører sig som serin. |
| Valin | V | Val | Essentiel for mennesker. Opfører sig som isoleucin og leucin. Se isoleucin. |
| Tryptofan | W | Trp | Essentiel for mennesker. Opfører sig som fenylalanin og tyrosin (se fenylalanin). Forstadie til serotonin. |
| Tyrosin | Y | Tyr | Opfører sig som fenylalanin og tryptofan (se fenylalanin). Forstadie til melanin, adrenalin og thyroidea-hormoner. |
Referencer
- Nelson, David L.; Cox, Michael M. (2000). Lehninger Principles of Biochemistry (3 udgave). Worth Publishers. ISBN 1-57259-153-6.
- Kyte, J.; Doolittle, R. F. (1982). "A simple method for displaying the hydropathic character of a protein". J. Mol. Biol. 157 (1): 105-132. PMID 7108955.
 | Wikimedia Commons har medier relateret til: |
Medier brugt på denne side
Forfatter/Opretter: Д.Ильин: vectorization, Licens: CC0
Structural formula of serine
Chemical structure of L-isoleucine
Forfatter/Opretter: Panoramix303, Licens: CC BY-SA 3.0
Chemical structure of L-leucine, shown as non-charged molecule
Zjednodušený racionální konstituční vzorec glycinu.
Imagen especular
phenylalanine