Ruthenium
| Ruthenium | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 Sølvhvidt metal | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Periodiske system | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Generelt | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomtegn | Ru | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomnummer | 44 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronkonfiguration | 2, 8, 18, 15, 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gruppe | 8 (Overgangsmetal) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Periode | 5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Blok | d-blok | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS-nummer | 7440-18-8 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomare egenskaber | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atommasse | 101,07 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kovalent radius | 126 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronkonfiguration | [Kr] 4d7 5s1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektroner i hver skal | 2, 8, 18, 15, 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kemiske egenskaber | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidationstrin | 2, 3, 4, 6, 8 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronegativitet | 2,2 (Paulings skala) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fysiske egenskaber | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tilstandsform | Fast | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Krystalstruktur | Hexagonal | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Massefylde (fast stof) | 12,45 g/cm3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Massefylde (væske) | 10,65 g/cm3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Smeltepunkt | 2334 °C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kogepunkt | 4150 °C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Smeltevarme | 38,59 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fordampningsvarme | 591,6 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Varmefylde | (25 °C) 24,06 J·mol–1K–1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Varmeledningsevne | (300K) 117 W·m–1K–1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Varmeudvidelseskoeff. | (25 °C) 6.4 µm·m−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektrisk resistivitet | 71 nΩ·m | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mekaniske egenskaber | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Youngs modul | 447 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Forskydningsmodul | 173 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kompressibilitetsmodul | 220 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Poissons forhold | 0,30 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Hårdhed (Mohs' skala) | 6,5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Hårdhed (Brinell) | 2160 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Ruthenium (efter Rus; latin for Rusland) er det 44. grundstof i det periodiske system: Under normale temperatur- og trykforhold optræder dette overgangsmetal som et hårdt, hvidt metal. Ruthenium udgør sammen med rhodium og palladium de lette platinmetaller.
Kemiske egenskaber
Ruthenium angribes ikke af syrer, men kan angribes af halogener ved høj temperatur, og opløses i smeltede, basiske stoffer. Stoffet reagerer med ilten i atmosfærisk luft, og danner derved rutheniumtetraoxid (RuO4).
Ruthenium optræder almindeligvis med oxidationstrinene +2, +3 og +4, men kan antage trin fra +1 til +8 samt −2.
Tekniske anvendelser
Ruthenium bruges i små mængder i legering med andre metaller for at forbedre disses egenskaber: For eksempel bliver titan omkring hundrede gange mere modstandsdygtigt overfor korrosion hvis det tilsættes 0,1 procent ruthenium, og legeringer med platin og palladium bliver langt hårdere og mere slidstærke ved tilsætning af ruthetium. Stoffet indgår også i andre "superlegeringer" til særlig krævende formål, for eksempel turbineblade til jetmotorer.
Ruthenium er også en alsidig katalysator, som er i stand til at spalte svovl-forbindelser, herunder svovlbrinte (H2S), og organiske metalkomplekser med ruthenium har for nylig vist sig at være gode katalysatorer for olefin-metathese. Metallet indgår desuden i specielle offeranoder til beskyttelse af nedgravede eller undersøiske metalkonstruktioner.
Visse ruthenium-kompleser absorberer lys i hele den synlige del af det elektromagnetiske spektrum, og der forskes i at udnytte dette til at forbedre solcellers ydeevne og gøre dem billigere. Andre rutheniumkomplekser har desuden en særlig egenskab som udnyttes i specielle ilt-sensorer: Tilstedeværelsen af ilt dæmper deres evne til at fluorescere.
I 1990 opdagede videnskabsfolk hos IBM, at ruthenium havde fremragende egenskaber som "luftgab" i tonehoveder, og i 2001 meddelte de at de kunne firedoble harddiskes lagerkapacitet i forhold til den tids standard, ved at udfylde gabet i drevets "tonehoveder" med et blot tre atomer tykt lag af ruthenium.
Forekomst og udvinding
Ruthenium er temmelig sjældent; på en liste over de mest udbredte grundstoffer i Jordens skorpe indtager det en 74.-plads. Det forefindes typisk sammen med andre metaller i platin-gruppen i Uralbjergene samt i Nord- og Sydamerika. Dertil findes der i Ontario i Canada en mindre men kommercielt vigtig forekomst.
Til kommerciel udvinding af det rene metal benyttes en kompliceret proces, hvori brint reducerer ammonium-ruthenium-klorid. Resultatet er et metalpulver, som smeltes eller svejses til massive stykker.
Ruthenium kan også udvindes af radioaktivt affald fra kernekraftværker; et kilogram af fissionsprodukterne af 235U indeholder 63,44 gram af forskellige isotoper af ruthenium med halveringstider længere end et døgn. Da brugt brændsel fra kernekraftværker typisk indeholder 3% fissionsprodukter, betyder det cirka 1,9 kg ruthenium per ton brugt brændsel. Dog vil indholdet af isotoperne 103Ru og 106Ru gøre det udvundne metal stærkt radioaktivt.
Historie
Den polske kemiker Jędrzej Śniadecki meddelte i 1807 at have fundet grundstoffet med atomnummer 44 ud fra platinholdige malme, men hans opdagelse kunne aldrig bekræftes, og han trak senere sin erklæring tilbage.
Jacob Berzelius og Gottfried Osann var tæt på i 1827; de undersøgte de uopløselige rester der blev tilbage, når de havde opløst "rå", naturligt forekommende platin fra Uralbjergene: Berzelius kunne ikke konstatere nogle "usædvanlige" metaller i resterne, men Osann mente at have fundet tre, hvoraf han foreslog navnet ruthenium for et af dem.
Den russiske videnskabsmand Karl Klaus opdagede og isolerede en "prøve" af 6 gram ruthenium i 1844, igen ud fra den rest der bliver til overs efter opløsening af "rå" platin i kongevand. Han valgte at opkalde sin opdagelse efter sit fødeland; han var født i Tartu i Estland, som på det tidspunkt var en del af de russiske imperie.
Isotoper af Ruthenium
Naturligt forekommende ruthenium består af syv stabile isotoper. Dertil kendes 18 radioaktive isotoper, hvoraf Ru-106 (halveringstid 373,59 døgn), Ru-103 (39,26 døgn) og Ru-97 (2,9 døgn) er de mest "langlivede".
| Wikimedia Commons har medier relateret til: |
|
Medier brugt på denne side
Forfatter/Opretter: Alchemist-hp (talk) (www.pse-mendelejew.de), Licens: FAL
One half of a high-purity (99.99%), electron-beam-remelted ruthenium bar. Size ca. 40 × 15 × 10 mm, weight ca. 44 g.
(c) Peo at the Danish language Wikipedia, CC BY-SA 3.0
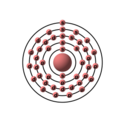
Denne tegning forestiller elektronkonfigurationen i et rutheniumatom: Den store kugle i midten forestiller atomkernen, og de små kugler er elektronerne. Bogstaverne på elektron-kuglerne angiver hvilken orbital de tilhører. Den lyserøde farve markerer at ruthenium hører til overgangsmetallerne. Udarbejdet af Peo, og frigivet under samme GFDL-betingelser som Wikipedia som helhed.