RNA-interferens

Nederst: Medfører RNA-interferens
RNA-interferens, RNAi eller RNA-dæmpning er en naturlig mekanisme i cellerne hos eukaryoter og bruges til specifikt at slukke for gener. Det er et specielt tilfælde af gendæmpning.
RNA-interferens er baseret på en interaktion mellem korte stykker RNA og mRNA med deltagelse af flere enzymkomplekser. Som et resultat opdeles mRNA'et i flere fragmenter og syntesen af et eller flere proteiner forhindres.
RNAi-mål inkluderer RNA fra virus og transposoner, hvilket er vigtigt for nogle former af det uspecifikke immunforsvar) og for reguleringen af udvikling samt vedligeholdelse af genomet.
De to amerikanske forskere Andrew Fire og Craig C. Mello modtog 2006 Nobelprisen i fysiologi eller medicin for deres opdagelse af mekanismen til RNA-interferens. I biovidenskab er RNA-interferens blevet etableret som en ny måde at lukke gener på også kaldet "gen-knockdown". Således blev de første lægemidler baseret på RNAi godkendt i 2018.
Mekanismen
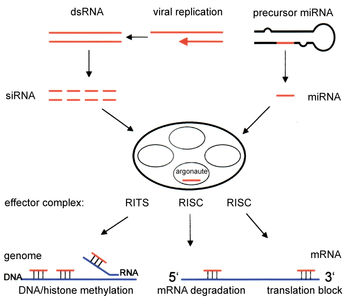
RNAi er en mekanisme, der hindrer eller hæmmer proteinsyntesen på translationsstadiet af specifikke gener. SiRNA (short interfering RNA eller silencing RNA) er nøglen til RNAi-processen og har en nukleotidsekvens, der er komplementær til den RNA-streng, der sigtes mod. Specifikke RNAi-proteiner ledes af siRNA til den givne mRNA, som kløves til mindre stumper, der ikke længere kan translateres til protein. En type af RNA transskriberet fra genomet, miRNA, arbejder på samme måde.[2]
RNAi-vejen påbegyndes af enzymet dicer, som beskærer lange dsRNA-molekyler til korte fragmenter på 20–25 basepar. En af de to strenge, kaldet “guidestrengen”, inkorporeres dernæst i det såkaldte RNA-induced silencing complex (RISC) og danner par med komplementære sekvenser. Det mest velundersøgte udfald af denne genkendelse er post-transcriptionel gen-dæmpning. Dette forekommer når guidestrengen specifikt parer med et mRNA-molekyle under medvirken af argonaut-proteiner, den katalytiske komponent i RISC-komplekset. Et andet udfald er epigenetiske ændringer i et gen – modifikation af histoner og methylering af DNA – der påvirker graden af genets transskription.
Den selektive og robuste effekt af RNAi på genudtrykket gør det til et værdifuldt værktøj i forskning – både i cellekulturer og i levende organismer fordi syntetisk dsRNA introduceret i celler kan inducere undertrykkelse af specifikke gener af interesse. RNAi kan også bruges i storskalascreeninger, der systematisk slukker for hvert gen i en celle, hvilket kan hjælpe med at identificere de komponenter, der er nødvendige for en bestemt cellulær proces eller en begivenhed som for eksempel celledeling. Udnyttelsen af denne vej er også et lovende værktøj i bioteknologi og medicin.
Historisk
Historisk var RNA-interferens kendt under andre navne, inklusive “post transcriptional gene silencing” og “quelling”. Kun efter disse tilsyneladende ubeslægtede processer var fulgt forståede, blev det klart, at de beskrev det samme, nemlig RNAi-fænomenet. RNAi har også været sammenblandet med antisenseundertrykkelse af genudtryk, hvilket ikke agerer katalytisk for at degradere mRNA, men i stedet involverer enkeltstrenget RNA-fragmenter, der fysisk binder til mRNA og blokerer translation. I 2006 delte Andrew Fire og Craig C. Mello Nobelprisen i fysiologi eller medicin for deres arbejde med RNA-interferens i nematoden C. elegans,[3] som de publicerede i 1998.[4]
siRNA som lægemiddel
Omkring 2020 blev der forsket intensivt i lægemidler baseret på nukleinsyrer.[5]
I 2018 blev det første siRNA-lægemiddel, Onpattro eller Patisiran, godkendt af FDA til at bruge lipidnanopartikler som drug delivery vehicle for RNA for første gang. Onpattro gives til behandling af arvelig transthyretin-medieret amyloidose med polyneuropati.
Se også
- Endogen retrovirus
- GMO
- Ikke-kodende DNA
- Ikke-kodende RNA
- mRNA-vaccine
- microRNA eller miRNA
- Onkogen
- ribozym
- tRNA eller transfer RNA
- rRNA eller ribosom RNA
Referencer
- ^ Hammond S, Bernstein E, Beach D, Hannon G (2000). "An RNA-directed nuclease mediates post-transcriptional gene silencing in Drosophila cells". Nature. 404 (6775): 293-6. doi:10.1038/35005107. PMID 10749213.
{{cite journal}}: CS1-vedligeholdelse: Flere navne: authors list (link) - ^ Morris KV (editor). (2008). RNA and the Regulation of Gene Expression: A Hidden Layer of Complexity. Caister Academic Press. ISBN 978-1-904455-25-7. http://www.horizonpress.com/rnareg.
{{cite book}}:|author=har et generisk navn (hjælp) - ^ Daneholt, Bertil. "Advanced Information: RNA interference". The Nobel Prize in Physiology or Medicine 2006. Hentet 2007-01-25.
- ^ Fire A, Xu S, Montgomery M, Kostas S, Driver S, Mello C (1998). "Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans". Nature. 391 (6669): 806-11. doi:10.1038/35888. PMID 9486653.
{{cite journal}}: CS1-vedligeholdelse: Flere navne: authors list (link) - ^ The expanding frontier of nucleic acid therapeutics. Nature Portfolio 2021
Medier brugt på denne side
Forfatter/Opretter: This figure is adapted from one by Matzke MA, Matzke AJM, Licens: CC BY 2.5
Overview of RNA interference. The dicer enzymes produce siRNA from double-stranded RNA and mature miRNA from precursor miRNA. miRNA or siRNA is bound to an argonaute enzyme and an effector complex is formed, either a RISC (RNA-induced silencing complex) or RITS (RNA-induced transcriptional silencing) complex. RITS affects the rate of transcription by histone and DNA methylation, whereas RISC degrades mRNA to prevent it from being translated.
Forfatter/Opretter: Dan Cojocari ✉·✍·, Licens: CC BY-SA 3.0
Lentiviral delivery of shRNA expression construct for stable integration and expresion of shRNA. ShRNA processing and inhibitory mechanisms.

