Pyridin
 Ikke at forveksle med Pyrimidin.
Ikke at forveksle med Pyrimidin.
| Pyridin | |||
|---|---|---|---|
 | |||
| Generelt | |||
| Andre navne | Azin Azabenzen | ||
| Molekylformel | C5H5N | ||
| Molarmasse | 79,10 g/mol | ||
| Fremtræden | Farveløs til gul væske[1] | ||
| CAS-nummer | |||
| EC-nummer | 203-809-9 | ||
| PubChem | |||
| SMILES | c1ccncc1 | ||
| InChI | 1/C5H5N/c1-2-4-6-5-3-1/h1-5H | ||
| Kemiske egenskaber | |||
| Massefylde | 0,982 g/cm3[2] | ||
| Opløselighed i vand | Blandbar | ||
| Smeltepunkt | −41,7 °C (231,8 K)[2] | ||
| Kogepunkt | 115,23 °C (388,38 K)[2] | ||
| Basestyrkekonstant (pKb) | 8,77[2] | ||
| Refraktionsindeks | 1,5095[2] | ||
| Viskositet | 0,88 cP | ||
| Struktur | |||
| Dipolmoment | 2,2 D | ||
| Termokemi | |||
| DeltaHf | 100,2 kJ/mol (l)[2] 140,4 kJ/mol (g)[2] | ||
| Std. molar entropi S | 177,9 J/(mol·K) (l)[2] 282,9 J/(mol·K) (g)[2] | ||
| Std. molar varmekapacitet, cp | 132,7 kJ/mol (l)[2] 78,1 kJ/mol (g)[2] | ||
| Sikkerhed | |||
| EU klassifikation | Brændbar (F) Sundhedsskadelig (Xn) | ||
| NFPA 704 | |||
| R-sætninger | R20, R21, R22, R34, R36, R38 | ||
| Flammepunkt | 21 °C (294 K) | ||
| Explosionsgrænser | 1,8 % – 12,4 %[1] | ||
| LD50 | 891 mg/kg (oralt, rotte) 1500 mg/kg (oralt, mus) 1580 mg/kg (oralt, rotte)[3] | ||
| Beslægtede stoffer | |||
| Andre aminer | Picolin Quinolin | ||
| Relaterede forbindelser | Anilin Pyrimidin Piperidin | ||
| Hvis ikke andet er angivet, er data givet for stoffer i standardtilstanden (ved 25 °C, 100 kPa) | |||
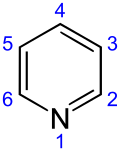
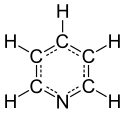
Pyridin er en basisk heterocyklisk organisk forbindelse med molekylformlen C5H5N. Strukturmæssigt minder pyridin om benzen med en methingruppe (=CH-) erstattet af et nitrogenatom. Pyridinringen indgår i mange vigtige forbindelse inklusive aziner og vitaminerne niacin og pyridoxal.
Pyridin blev opdaget i 1849 af den skotske kemiker Thomas Anderson som en af bestanddelene i Dippels olie. To år senere lykkedes det Anderson at isolere ren pyridin ved fraktionel destillering af olien. Det er en farveløs, meget brændbar, svagt alkalisk, vandopløselig væske med en karakteristisk ubehagelig fiskeagtig lugt.
Pyridin bruges i fremstillingen af agrokemikalier og lægemidler og er også et vigtigt opløsningsmiddel og reagens. Ethanol tilsættes pyridin for at gøre det uegnet til at drikke. Det bruges i in vitro-syntese af DNA i syntesen af sulfapyridin (et sulfapræparat til behandling af bakteriel infektion), antihistamin, tripelenamin, mepyramin, baktericider og herbicider.
Visse kemiske stoffer er derivater af pyridin. Disse inkluderer B-vitaminerne niacin og pyridoxal, nikotin og andre nitrogenholdige planteprodukter. Historisk blev pyridin produceret fra stenkulstjære og som et biprodukt af gasificering af kul. Et stigende behov for pyridin resulterede dog i udviklingen af mere økonomiske metoder til syntese af acetaldehyd og ammoniak. Der produceres årligt mere end 20.000 ton pyridin.
Referencer
- ^ a b "NIOSH Pocket Guide to Chemical Hazards #0541". National Institute for Occupational Safety and Health (NIOSH). Websted besøgt 29. september 2016. (engelsk)
- ^ a b c d e f g h i j k Andersen, Erik Strandgaard; Jespergaard, Paul; Østergaard, Ove Grønbæk. DATABOG fysik kemi, 11. udgave, pp. 108-109. København: F & K forlaget, 2009. ISBN 978-87-87229-61-6.
- ^ "Pyridine". Immediately Dangerous to Life and Health. National Institute for Occupational Safety and Health (NIOSH). Websted besøgt 29. september 2016. (engelsk)
|
Medier brugt på denne side
Ball-and-stick model of the pyridine molecule, C5H5N.
Structural information (determined by microwave spectroscopy) from CRC Handbook, 88th edition.
Image generated in Accelrys DS Visualizer.numbering of pyridine
Space-filling model of the pyridine molecule, C5H5N.
Structural information (determined by microwave spectroscopy) from CRC Handbook, 88th edition.
Image generated in Accelrys DS Visualizer.Full structural formula of the pyridine molecule, a simple aromatic heterocyclic compound, commonly used as a building block for agrochemicals and pharmaceuticals.