Proteindomæne





Et proteindomæne er en funktionel og strukturel del af et proteinmolekyle, der kan fungere, eksistere og udvikles uafhængigt af resten af proteinkæden. Mange proteiner består af flere strukturelle domæner, ligesom et domæne kan være genbrugt og bevaret i en række forskellige proteiner med den samme, en lignende eller en forskellig funktion.
Et domæne danner en kompakt tertiær struktur, dvs. tredimensionel struktur. Domæner kan variere i længde fra mellem ca. 25 aminosyrer op til mere end 500 aminosyrer i længden. De korteste domæner, såsom zink-fingrene, er stabiliseret af metalioner eller disulfid-broer. Der kan skelnes mellem domæner, der har strukturel funktion, enzymatisk funktion og en molekyle-bindende funktion.
Ligesom de mindre moduler og motiver kan domæner betragtes som den biologiske evolutions byggeklodser, der kombineres i forskellige arrangementer for at danne proteiner med forskellige og nye funktioner. Genbrug af domæner og udvikling af nye funktioner er et eksempel på molekylær evolution.[1]
Enzymatiske domæner
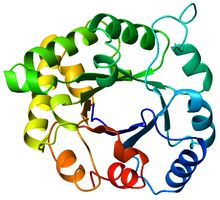
TIM-tønden (TIM barrel efter enzymet triosephosphate isomerase) er et af de mest bevarede, modificerede og genbrugte proteindomæner. Mere end 26 enzymfamilier, dvs. mere end 300 distinkte enzymer bruger TIM-tønden som basis for det enzymatiske sæde som f.eks. i enzymet pyruvatkinase. TIM-tønden består af otte α-helixer alternerende med otte parallelle β-kæder (se billederne) uden ret meget sekvenshomologi, dvs. uden ret mange ligheder i rækkefølgen af aminosyrer.
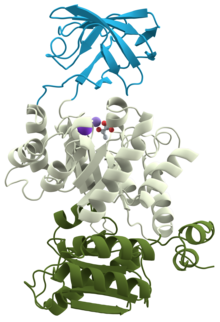
Tryptophanhydroxylase er et enzym, der ligesom andre hydroxylaser består af tre domæner, hvoraf det ene er det katalytiske domæne[2]. De to andre domæner er et N-terminalt regulatorisk domæne og et mindre C-terminalt tetrameriseringsdomæne.[3]
DNA-bindende domæner
Et DNA-bindende domæne (ofte kaldet DBD) kan binde sig til en specifik DNA-sekvens eller have en generel affinitet til DNA.
Kernereceptorer er transkriptionsfaktorer der ud over det DNA-bindende domæne (se illustrationen for oven) også har frie andre domæner inkl. det ligandbindende domæne.
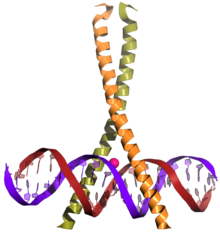
bZIP (leucine zipper, leucinlynlåsen) er et meget udbredt domæne, en dimer af et strukturmotiv: en alfa-helix med aminosyren leucin på hver syvende plads. Leucinlynlåsen findes som det DNA-bindende domæne i transkriptionsfaktorer i alle eukaryoter.
Proteinbindende domæner
Her er nogle eksempler på protein-bindende domæner:
Ig-domænet, immunoglobulin-domænet eller det immunglobulin-lignende domæne træffes i hundredvis af proteiner, antistoffer, celleadhæsionsproteiner og receptortyrosinkinase m.fl., der tilsammen udgør immunglobulin-superfamilien (IGSF). Den extracellulære del af NCAM (neuronal cell adhesion molecule) består af fem antistof-lignende (immunoglobulin-like (Ig) domains) og to fibronectin type III (FNIII) domæner.[4] Immunglobulin-domænet kan udover proteiner også binde til andre ligander.
SH2-domænet (efter Src Homology 2) findes i Src-onkoproteinet og mange andre proteiner i signaltransduktionen. SH2-domæner tillader proteinerne at binde sig til fosforyleret tyrosin, bl.a. i reaktionsvejene fra receptortyrosinkinase.
SH3-domænet (efter Src homology 3) er et lille domæne af omkring 60 aminosyrer og findes i en række proteiner med forskellig funktion bl.a. enzymer (phosphatidylinositol 3-kinaser og phospholipaser). SH3-domæner binder til proteiner med en primær struktur med tætsiddende proliner.
For flere eksempler se afsnittet Domains her en:Protein–protein interaction
Membran-bindende domæner
Det fosfolipid-bindende PH-domæne (efter Pleckstrin homology domain) er et domæne bestående af omkring 120 aminosyrer og findes i en lang række proteiner i cytoskelettet og signaltransduktion.
Transmembrane domæner
Et transmembran-domæne er et hydrofobt stykke af en α-helix, en aminosyre-kæde der krydser en cellemembran eller en intracellulær membran. Transmembrane proteiner kaldes ofte bare membranproteiner; de kan bestå af alt fra en til ... transmembrane domæner. Typiske eksempler er tetraspaninerne med fire transmembrane domæner og 7TM-receptorerne.
Genbrug
Genbrug af domæner og udvikling af nye funktioner er et eksempel på molekylær evolution. Eksempelvis er der omkring 260 humane proteiner med PDZ-domænet (en).
Specielle domæner
En speciel gruppe domæner er de såkaldte mikroproteiner, små proteiner eller peptider, der kun består af et domæne.
Se også
Henvisninger
- ^ Protein Domains, Motifs, and Folds in Protein Structure. Libre Texts 2020
- ^ Tryptophanhydroxylase i Proteopedia
- ^ "The domains comprising each subunit of the phenylalanine hydroxylase". Arkiveret fra originalen 31. maj 2017. Hentet 30. januar 2018.
- ^ Structure and Interactions of NCAM Ig1-2-3 Suggest a Novel Zipper Mechanism for Homophilic Adhesion. ScienceDirect Structure 2003
Medier brugt på denne side
Forfatter/Opretter: Thomas Splettstoesser (www.scistyle.com), Licens: CC BY-SA 3.0
Visualization of the three domains of the protein Pyruvate kinase. Based on PDB: 1PKN
Forfatter/Opretter: Yikrazuul, Licens: CC BY-SA 3.0
leucine zipper: CREB-1 binding to DNA. Data used from 1dh3. The magnesium ion is colored in green
Forfatter/Opretter: Andrei Lomize, Licens: CC BY-SA 3.0
Pleckstrin homology domain (PH domain) of tyrosine-protein kinase Bruton-Tyrosinkinase (BTK)
Protein image from OPM databaseForfatter/Opretter: AllWorthLettingGo, Licens: CC BY-SA 3.0
The Modular Structure of Fibronectin with its Binding Domains
Forfatter/Opretter: The original uploader was WillowW at engelsk Wikipedia., Licens: CC BY-SA 3.0
Top view of a TIM barrel (PDB accession code 8TIM). Made with MOLMOL.
Forfatter/Opretter: The original uploader was WillowW at engelsk Wikipedia., Licens: CC BY-SA 3.0
Ribbon diagram of a TIM barrel (PDB accession code 8TIM). Made with MOLMOL.
(c) WillowW fra en.wikipedia.org, CC BY-SA 3.0
Ribbon diagram of the SH3 domain, alpha spectrin, from chicken. Made with MOLMOL.









