Protein




Proteiner er store molekyler (makromolekyler), der er essentielle komponenter af alle levende organismer. De deltager i alle cellulære processer, og fungerer som biologiske byggesten og som enzymer (katalysatorer) for de kemiske reaktioner, der foregår i alle levende organismer. Andre eksempler på proteiner er antistoffer (immunoglobuliner), (nogle) hormoner, transportmolekyler, celleadhæsionsmolekyler og lectiner. "The human protein atlas" beskriver 20 035 humane gener og genprodukter, og der kendes ca. 200 millioner proteiner.[1][2]
Proteiner udgør en fundamental del af de levende organismer, og hvis et protein af den ene eller den anden grund er "beskadiget" som efter en mutation eller slet ikke dannes, går det ud over den enkelte organismes funktion.
GPCR omtales som "det mest livsvigtige protein", egentlig en gruppe af mere end 800 membranbundne receptorer med lige så mange celle-funktioner.[3] Det mest udbredte protein på Jorden antages at være RuBisCO, det første enzym i fotosyntesen.
Proteiner i menneskets fødemidler er først og fremmest leverandører af aminosyrer, byggesten til syntesen af organismens egne proteiner. Proteiner er dog også energigivende næringsstoffer, og den fysiologiske brændværdi er 17kJ/g. Det kemiske energiindhold i proteiner er generelt større og afhænger af det specifikke protein.
For udforskningen af proteiners opbygning modtog den amerikanske kemiker Linus Pauling Nobelprisen i kemi i 1954.[4]
Proteiners opbygning

Proteiner består af polypeptidkæder (poly betyder mange), der er opbygget af aminosyrer som er kovalent sammenbundet via peptidbindinger. En polypeptidkæde er altså en kæde, der består af mange peptidbindinger. Korte kæder benævnes ofte oligopeptid eller blot peptid. Der er ikke defineret nogen grænse for, hvor lang en kæde skal være, for at kunne kaldes et protein.
Proteiner er opbygget fra et repertoire på 20 forskellige aminosyrer, der kaldes de proteinogene aminosyrer. Normalt ses kun 20 af dem, og det er kun disse 20, der indgår i en ny syntetiseret peptidkæde; de sidste 2 (hydroxyprolin og selenocystein) dannes ved post- eller kotranslationel modifikation.
Den primære struktur
Proteiners opbygning beskrives på fire niveauer. Det laveste niveau kaldes den primære struktur eller den kovalente struktur. Disse to begreber er ikke helt identiske. Den primære struktur beskriver aminosyrernes rækkefølge. Denne er unik for et bestemt protein og er bestemt af generne. Den primære struktur kaldes også for den kovalente struktur, i hvilket tilfælde beskrivelsen også omfatter disulfidbroer[5] og andre broer opbygget af sidekæderne på aminosyrerne.
Den sekundære struktur
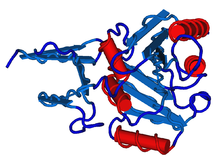

Den sekundære struktur er mønstre som polypeptidkæden kan være foldet i. Disse kaldes for strukturelementer, og inkluderer α-helix og β-strenge, som holdes af hydrogenbindinger eller af β-turns. En del af en polypeptidkæde som ikke er foldet kaldes for tilfældig kæde eller random coil.
Det er aminosyrerne som bestemmer hvilke sekundære strukturelementer der er til stede, eller ikke til stede, i et protein. Nogle aminosyrer har stor tilbøjelighed til at fremme dannelsen af helixer, andre fremmer dannelsen af strenge og andre igen foretrækker en tilfældig kæde. Men de fleste af aminosyrerne kan tvinges til at antage en ufavorabel struktur, hvis de sidder i mellem andre aminosyrer som foretrækker lige netop denne.
Nogle proteiner indeholder næsten kun en slags strukturelement, mens andre består af en blanding af forskellige slags. Nogle strukturelementer kaldet motiver har vist sig at være evolutionært stabile og gennemgående i flere eller mange proteiner.
Den tertiære struktur
Den tertiære struktur er den måde de enkelte sekundære strukturelementer ligger i forhold til hinanden. F.eks. er en polypeptidkæde der består af 5 helixer sjældent blot 5 helixer som flyder rundt i mellem hinanden. I stedet pakkes de ofte sammen for at holde fast på en ligand, eller for at forhindre vand eller salt at trænge ind. De sekundære strukturelementer holdes i sådanne tilfælde sammen af hydrogenbindinger, ionbindinger, svovlbroer eller hydrofobe interaktioner.
Nogle tertiære strukturelementer kaldet domæner og moduler har vist sig evolutionært stabile og være gennemgående strukturelle elementer for den samme, en lignende eller forskellig funktion, jf. strukturel gruppering, som f.eks. en beta-barrel, på dansk en beta-tønde, der er et beta-sheet formet som en cylinder, hvorved der dannes en lukket struktur, der kan binde ligander som i lipocalinerne.
Den kvarternære struktur


Et proteins kvarternære struktur er den struktur, der dannes når flere polypeptidkæder sammen fungerer som et stort protein. De enkelte polypeptidkæder kaldes så for subunits eller underenheder.
Intrinsikt uordnede proteiner
Proteiner uden indre orden er en meget stor og funktionelt vigtig klasse af proteiner, og deres opdagelse har modbevist ideen om, at en fast tredimensional struktur er en forudsætning for den biologiske funktion. For eksempel er proteiner uden indre orden blevet identificeret i at deltage i DNA-regulering og i cellesignalering, desuden er de impliceret i en række sygdomme, herunder kræft, hjerte-kar-sygdomme, amyloidoser, neurodegenerative sygdomme og diabetes.
Posttranslationale modifikationer
Mange proteiner modificeres med andre funktionelle grupper eller ændres strukturelt som for eksempel glycoproteiner. Et eksempel på en meget almindelig modifikation er etableringen af en disulfidbro mellem to cysteiner. Andre eksempler på modifikationer er: acylering, acetylering, metylering, amidering, biotinylering, formylering, fosforylering, gamma-carboxylering, glutamylering, glycosylering, glycinylering, hydroxylering, iodinering, isoprenylering, myristinoylering, farnesylering, geranylgeranylering, oxidering, palmitinoylering, polysialylering og sulfatering. Desuden kovalent addering af hæm, GPI-anker, nucleotider, flavin, phosphatidylinositol, og andre proteiner/oligopeptider.
Typer af proteiner
Proteiner inddeles overordnet i to hovedklasser:
- Vandopløselige proteiner
- Membranproteiner
De to typer af proteiner har forskellige egenskaber pga. de meget forskellige miljøer de befinder sig i.
Vandopløselige proteiner
Vandopløselige proteiner findes overalt i celler og i den extracellulære væske. For at være opløselige i vand, som er et polært solvent, har denne type proteiner ofte mange ladede aminosyrer og uladede aminosyrer med hydrofile sidekæder, der sidder så de vender ud imod solventet (vand). Hydrofobe aminosyrer er ofte 'gemt væk' inde i proteinets rumlige struktur, således at de vender væk fra vandet. Det er energetisk ufavorabelt at tvinge hydrofobe aminosyrer ud i et polært solvent, de foretrækker at interagere med andre hydrofobe aminosyrer. Disse hydrofobe interaktioner er medvirkende til at stabilisere proteiners rumlige struktur.
Membranproteiner
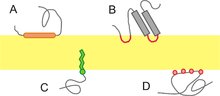

Der er to slags membranproteiner, de perifere membranproteiner og de integrerede membranproteiner. Perifere membranproteiner findes i tæt kontakt med membranen, og er ofte bundet til denne via f.eks. hydrofobe eller elektrostatiske interaktioner. Andre er forankret i lipiddobbeltlaget ved hjælp af eksempelvis en kovalent bundet fedtsyre. Mange perifere membranproteiner kan løsnes fra membranen ved at ændre på f.eks. pH, temperatur eller saltkoncentration.
De integrerede membranproteiner sidder inde i membranens lipiddobbeltlag, nogle er næsten helt gemt i dobbeltlaget, mens andre stikker ud af membranen på den ene eller begge sider. Typiske eksempler på integrerede membranproteiner er receptorerne, typisk 7TM-receptorerne.
Lipiddobbeltlaget kan betragtes som solvent for de integrerede membranproteiner. Dobbeltlagets centrale del, som består af fedtsyrekæder, er apolært og hydrofobt. Det betyder at den del af membranproteiner der sidder inde i membranen, i modsætning til vandopløselige proteiner, har hydrofobe aminosyrer på overfladen. Proteiner der fungerer som vand- eller ionkanaler har typisk hydrofile aminosyrer vendende ind mod kanalens centrum.
Nedbrydning af proteiner i kroppen
Proteiner som vi indtager med føden bruges ikke i kroppen i de respektive strukturer de har, når de indtages. Som tidligere nævnt er proteiner opbygget af aminosyrer, som skal ses som en slags byggeklodser. Når proteiner indtages, nedbrydes de således til enkelte aminosyrer, dog findes der stadig enkelte dipeptider og tripeptider (henholdsvis 2 og 3 aminosyrer sat sammen). Nedbrydningen begynder i mavesækken, hvor det proteolytiske enzym pepsin kløver proteinerne i mindre stykker. De mindre stykker bliver videre nedbrudt i tolvfingertarmen af flere forskellige proteolytiske enzymer, de vigtigste er trypsin og chymotrypsin, ned til korte aminosyrekæder, kaldet peptider. Den sidste kløvning sker af proteolytiske børstesømenzymer, hvoraf det vigtigste er enterokinase og herefter er kun få di- og tripeptider at finde. Resten er omdannet til enkelte aminosyrer. Nu transporteres aminosyrerne, samt di- og tripeptiderne ind i tarmepithelcellerne vha. transportører, igennem disse celler og optages via cellens basolaterale membran i blodkarrene. Fra blodkarrene transporteres de rundt til alle kroppens celler, hvori de fungerer som byggeklodser for syntese af nye proteiner. Syntesen på celleniveau foregår hovedsageligt i det Endoplasmatiske Reticulum
Proteiner som molekylære byggesten
Cellens byggesten er bl.a. de strukturelle proteiner, der fungerer som "mursten": kollagen og keratin i f.eks. insekters exo-skelet, hud, hår, uld, næb, hove, klove, kløer, horn og negle. Muskelfibre er bygget op blandt andet af strukturelle proteiner. Strukturelle proteiner i kroppens væv er opbygget af aminosyrer. De essentielle aminosyrer, altså de aminosyrer kroppen ikke selv kan danne, er særligt vigtige at få tilført gennem kosten, for at kunne vedligeholde og opbygge kropsvæv.
Protein som bestanddel i kosten
Protein udgør sammen med fedt og kulhydrat kostens makronæringsstoffer. Voksne menneskers daglige proteinbehov er jævnfør WHO 0,83 g pr. kg kropsvægt, ækvivalent til 10-20 % af kostens energiindhold. I forbindelse med fysisk aktivitet kan proteinbehovet øges til mellem 1,2-2,0 g pr. kg kropsvægt, hvor kredsløbstræning er i den lave ende og styrketræning er i den høje ende. I et ernæringsmæssigt perspektiv er det særligt vigtigt at indtage protein med et komplet indhold af essentielle aminosyrer. Den ernæringsmæssige kvalitet af proteiner i fødevarer, bedømmes altså ud fra indholdet og optageligheden af essentielle aminosyrer, typisk vurderet ved enten PDCAAS- eller DIAAS-metoden. Animalske proteinkilder som kød, fisk, æg og mejeriprodukter har generelt et højere og mere komplet indhold af essentielle aminosyrer end vegetabilske proteinkilder, hvorfor vegetarer og veganere i højere grad bør sikre sig at indtage tilstrækkeligt med protein, fra varierede fødevarekilder. Vegetabilske kilder til protein indbefatter blandt andet bønner, bælgfrugter, nødder og kornprodukter.[6]
Proteiner som enzymer, biologiske katalysatorer
Proteiner, der virker som katalysatorer, kaldes enzymer. De er vigtige, da mængden af de enkelte enzymer styrer, hvor hurtigt de forskellige biokemiske reaktioner forløber. Dermed styrer de f.eks. den enkelte celles stofskifte. Enzymers navn ender ofte på -ase, og fortæller om deres virkning. F.eks. virker enzymet alkohol dehydrogenase formelt ved at fjerne hydrogen fra alkohol, og omdanne det til acetaldehyd. Der er dog undtagelser, som f.eks. fordøjelsesenzymet trypsin. Proteiner udgør en fundamental del af de levende celler, og hvis et protein af den ene eller den anden grund er "beskadiget" som efter en mutation eller slet ikke dannes, går det ud over den enkelte celles funktion.
Proteiner som ligand-bindende molekyler
Proteiners meget specifikke binding af ligander danner også basis for mange andre funktioner. Som eksempler kan nævnes antistoffer (immunoglobuliner), hormoner, transportmolekyler, enzymhæmmere, adhæsionsmolekyler, toksiner, receptorer, lectiner og mikroproteiner.
Et eksempel på et ligand-bindende protein er receptoren CCR5, der binder HIV således at virusset kan trænge ind i cellerne, men en sjælden mutation (tabsmutationen CCR5-Δ32, hvor 32 aminosyrer mangler) medfører netop at HIV ikke kan binde sig til receptoren og trænge ind i cellerne.[7]
Se også
- ACE2
- Acetylcholinesterase
- Akutfaseproteiner
- Albumin
- Alpha-synuclein
- Antigen
- Aquaporin
- Antistoffer
- Bakterierhodopsin
- Beta-barrel
- Blodproteiner
- C-reaktivt protein
- Calycin
- CD4
- Cytokin
- Defensiner
- DNA-bindende proteiner
- Erythropoietin, EPO
- Fibrin
- Fluoriserende proteiner
- Galectin
- Glykoproteiner
- G-protein-koblede receptorer, GPCR eller 7TM
- Grønt fluorescerende protein, GFP
- Histon
- Hormoner
- Huntingtin
- Hæmoglobin
- IGF-1 (Insulin-like Growth Factor-1)
- Immun-checkpoints
- Immunglobulin-superfamilien
- Inflammasom
- Insulin
- Intrinsikt uordnet protein, IDP
- Ionkanaler, Kaliumkanal
- Kapsid, Proteinkappe (virus)
- Kasein
- Kernereceptor
- Komplementsystemet
- Lektin
- Lysozym
- Miraculin
- Myoglobin
- Natrium-kalium-pumpen
- Opioid-receptor
- p53
- Peptider, Neuropeptider
- Pikachurin
- Plasmaproteiner
- Polymerase, RNA-polymerase
- PolyQ-tragt, PolyQ-sygdomme
- Porin
- Prioner
- Protein uden indre orden
- Proteindomæne
- Proteinkinase
- Proteinpulver
- Proteom, Proteomics
- Receptor, Receptortyrosinkinase
- Revers transkriptase
- RuBisCO
- Sonic hedgehog
- Spike, virus overfladeprotein
- TATA-bindende protein
- Tau-protein
- Thyroideastimulerende hormon, TSH
- Toll-like receptor
- Transskriptionsfaktor
- Tumorsuppressor
Referencer
- ^ The human protein atlas
- ^ ‘The entire protein universe’: AI predicts shape of nearly every known protein. Nature 2022
- ^ Exploring the Elusive World of Life's Most Vital Proteins. Livescience
- ^ "Linus Pauling - pionér og fredsaktivist. Biokemisk Forening 2001". Arkiveret fra originalen 19. juni 2015. Hentet 14. november 2019.
- ^ Livets kemi under lup. DTU
- ^ Alt der er at vide om protein. Bodylab
- ^ Only 1 Person Has Been Cured of HIV: New Study Suggests Why. Livescience
Eksterne henvisninger
- Et proteinmolekyle folder sig sammen til en kompakt klump og opnår stabilitet
- Proteinindholdet i udvalgte fødevarer på det danske marked
- Proteopedia viser mere end 10.000 tredimensionale molekylmodeller af proteiner, proteinfragmenter og proteinkomplekser
- Lysende proteiner. Videnskab.dk
- Proteins are the Body's Worker Molecules. The Structure of Life. NIH Arkiveret 7. juni 2014 hos Wayback Machine
 | Wikimedia Commons har medier relateret til: |
Medier brugt på denne side
Forfatter/Opretter: Axel Griewel, Licens: CC BY-SA 3.0
Examples of protein structures and complexes of different sizes as available from the PDB an EMDB
Crystal structure of oncostatin M as published in the Protein Data Bank (PDB: 1EVS)
Spacefilling structure of RuBisCO created using Rasmol and the 8RUC file from the Protein Data Bank.
Forfatter/Opretter: Nevit Dilmen, Licens: CC BY-SA 3.0
1A0L_Human_Beta-Tryptase
Forfatter/Opretter: Opabinia regalis, Licens: CC BY-SA 3.0
Three views of one monomer of the protein triose phosphate isomerase (PDB ID 1TIM). Left, an all-atom view colored by atom type; middle, a cartoon view colored by secondary structure; right, a solvent-accessible surface view colored by residue type (acidic residues red, basic residues blue, polar residues green, nonpolar residues white).
Schematic representation of peripheral membrane proteins, similar to Image:Monotopic membrane protein.png but without english annotations]]
Schematic representation of integral membrane proteins. Similar to Image:Polytopic membrane protein.png, but without english annotations
A 3D model of an Immunoglobulin molecule, showing heavy chains in blue and light chains in green. By the National Library of Medicine
Forfatter/Opretter: en:User:Diberri (me), Licens: CC BY-SA 3.0
The tetradecameric assembly of the association domain of Ca2+/calmodulin-dependent kinase II (CaMKII), created from 1hkx.pdb using PyMol.
Forfatter/Opretter: Opabinia regalis, Licens: CC BY-SA 3.0
Assembled human PCNA (PDB ID 1AXC), a sliding DNA clamp protein that is part of the DNA replication complex and serves as a processivity factor for DNA polymerase. The three individual polypeptide chains that make up the trimer are shown.










