Permanganat
| Permanganat | |
|---|---|
 | |
 | |
| Generelt | |
| Systematisk navn | Permanganat |
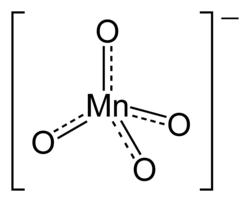
| Molekylformel | MnO4- |
| Molarmasse | 118,94 g/mol |
| Fremtræden | Kraftigt rødviolet (i vandig opløsning) |
| Struktur | |
| Termokemi | |
| DeltaHf | -541,4 kJ mol-1[1] |
| Std. molar entropi S | 191,2 J mol-1 K-1[1] |
| Std. molar varmekapacitet, cp | -82,0 J mol-1 K-1[1] |
| Hvis ikke andet er angivet, er data givet for stoffer i standardtilstanden (ved 25 °C, 100 kPa) | |
Permanganat er betegnelsen for ionen MnO4−, i hvilken grundstoffet mangan optræder i sit højeste oxidationstrin (+7). Salte, hvori permanganationen indgår, kaldes tillige permanganater, f.eks. kaliumpermanganat. Permanganat er et kraftigt oxidationsmiddel. Oxygenatomerne i permanganat er arrangeret omkring manganatomet i en tetraederstruktur.[2] Vandige opløsninger af permanganat fremtræder kraftigt rødviolette.
Kemi
I sur opløsning reduceres permanganat til farveløse eller svagt lyserøde Mn2+-ioner (hvori mangan har oxidationstrinnet +2).
- 8 H+ + MnO4− + 5 e− → Mn2+ + 4 H2O
I stærkt basisk opløsning reduceres permanganat til manganat, MnO2−4, i hvilken mangan har oxidationstrinnet +6. Manganat fremtræder grøn.
- MnO4− + e− → MnO2−4
I neutral opløsning vil permanganat reduceres til brun MnIV i form af MnO2 (brunsten).
- 2 H2O + MnO4− + 3 e− → MnO2 + 4 OH−
I salpetersur vandig opløsning oxideres alle manganforbindelser med oxidationstrin mindre end +7 af mønje (Pb3O4) eller natriumbismuthat(V) (NaBiO3) til permanganat.[3]
Referencer
- ^ a b c Andersen, Erik Strandgaard; Jespergaard, Paul; Østergaard, Ove Grønbæk. DATABOG fysik kemi, 11. udgave, pp. 80-81. København: F & K forlaget, 2009. ISBN 978-87-87229-61-6.
- ^ Sukalyan Dash, Sabita Patel & Bijay K. Mishra (2009). "Oxidation by permanganate: synthetic and mechanistic aspects". Tetrahedron. 65 (4): 707-739. doi:10.1016/j.tet.2008.10.038. (engelsk)
- ^ Andersen, Peter; Døssing, Anders, og Mønsted, Ole. Grundstoffernes kemi i vandig opløsning. Kemisk Institut, Københavns Universitet, 2014.
Medier brugt på denne side
Forfatter/Opretter: CCoil (talk), Licens: CC BY-SA 3.0
Permanganate anion
Permanganate anion