Perklorsyre
| Perklorsyre | |||
|---|---|---|---|
 | |||
| Generelt | |||
| Systematisk navn | Perklorsyre | ||
| Andre navne | Perchlorsyre | ||
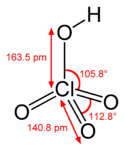
| Molekylformel | HClO4 | ||
| Molarmasse | 100,46 g/mol | ||
| Fremtræden | Farveløs væske | ||
| CAS-nummer | |||
| PubChem | |||
| SMILES | OCl(=O)(=O)=O | ||
| InChI | 1/ClHO4/c2-1(3,4)5/h(H,2,3,4,5) | ||
| Kemiske egenskaber | |||
| Massefylde | 1,77 g/cm3[1] | ||
| Opløselighed i vand | Blandbar | ||
| Smeltepunkt | -112 °C (161,15 K)[1] | ||
| Kogepunkt | Dekomponerer ved 90 °C (363,15 K)[1] | ||
| Syrestyrkekonstant (pKa) | <−10[1] | ||
| Struktur | |||
| Termokemi | |||
| DeltaHf | −40,6 kJ/mol[1] | ||
| Sikkerhed | |||
| EU klassifikation | Oxiderende (O) Ætsende (C) | ||
| NFPA 704 | |||
| R-sætninger | R5, R8, R35 | ||
| S-sætninger | S1/2, S23, S26, S36, S45 | ||
| Beslægtede stoffer | |||
| Relaterede forbindelser | Saltsyre Hypoklorsyrling Klorsyrling Klorsyre | ||
| Hvis ikke andet er angivet, er data givet for stoffer i standardtilstanden (ved 25 °C, 100 kPa) | |||
Perklorsyre er en mineralsk syre med den kemiske formel HClO4. Den fremtræder som en farveløs væske. Perklorsyre er en stærkere syre end svovlsyre og salpetersyre. I praksis bruges hovedsageligt vandige opløsninger af perklorsyre. Varm perklorsyre er et kraftigt oxidationsmiddel; ved stuetemperatur udviser vandige opløsninger af perklorsyre (op til 70 vægt-%) dog generelt kun syreegenskaber uden samtidig at være oxiderende. Perklorsyre er nyttig i fremstillingen af perkloratsalte, især ammoniumperklorat (NH4ClO4), som er en vigtig bestanddel i raketbrændstof. Perklorsyre er stærkt ætsende og danner let potentielt eksplosive kemiske blandinger.
Referencer
Eksterne henvisninger
- International Chemical Safety Card 1006 (engelsk)
|
Medier brugt på denne side
Forfatter/Opretter: W. Oelen, Licens: CC BY-SA 3.0
Appr. 40 ml of 60% perchloric acid.
Molecular geometry of perchloric acid, HClO4, determined by electron diffraction in the gas phase. Based on Norman N. Greenwood, Alan Earnshaw (1997) Chemistry of the Elements (2nd ed.), Butterworth-Heinemann, pp. 866−867 ISBN: 978-0-08-037941-8.