Natriumborhydrid
| Natriumborhydrid | ||||
|---|---|---|---|---|
 | ||||
| Generelt | ||||
| Systematisk navn | Natriumtetrahydridborat(1–) | |||
| Molekylformel | NaBH4 | |||
| Molmasse | 37.83 g/mol | |||
| CAS nummer | [16940-66-2] | |||
| PubChem | ||||
| Egenskaber | ||||
| Massefylde | 1.0740 g/cm3 | |||
| Smeltepunkt | 400 °C | |||
| Kogepunkt | 500 °C | |||
| Sikkerhed | ||||
| MSDS | ICSC 1670 | |||
| NFPA 704 | ||||
| Flammepunkt | 70 °C | |||
| Selvantændelses- temperatur | ca. 220 °C | |||
| Beslægtede Stoffer | ||||
| Beslægtede stoffer | Lithiumaluminiumhydrid | |||
| Hvis ikke andet er angivet, er data givet for stoffer i standardtilstanden (ved 25 °C, 100 kPa) | ||||
Natriumborhydrid, også kendt som natriumtetrahydridborat, har den kemiske formel NaBH4. Det er hvidt og fast, og fremtræder normalt som pulver, er et reduktionsmiddel der anvendes til fremstilling af lægemidler og andre organiske og uorganiske forbindelser. Det er opløseligt i alkohol og vand.
Fysiske egenskaber
Natriumborhydrid er et lugtfrit hvidt til grå-hvidt mikrokrystallinsk pulver, som ofte danner klumper. Det er opløseligt i vand, dog efterfulgt af en kraftig reaktion.
Struktur
NaBH4 har tre kendte polymorfer: α, β og γ. Den stabile fase ved stuetemperatur og tryk forekommer α-NaBH4, som er kubisk og minder om en NaCl-typestruktur i Fm3m-gruppe. Ved et tryk på 6,3 GPa, ændres strukturen til den tetragonale β-NaBH4 (gruppe P421c) og ved et tryk på 8,9 GPa, ændres det til γ-NaBH4 (gruppe Pnma), som er den mest stabile.
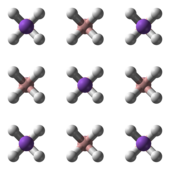 | 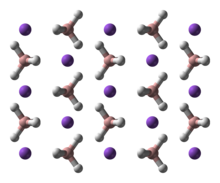 | 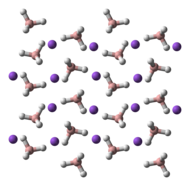 |
Syntese og fremstilling
Natriumborhydrid fremstilles ved reaktion mellem natriumhydrid og trimethylborat ved 250-270 °C:
B(OCH3)3 + 4 NaH → NaBH4 + 3 NaOCH3
Det kan også genereres ved hjælp af NaH på pulveriseret borsilikatglas. NaBH4 kan rekrystallisere ved opløsning i varmt (50 °C) diglym efterfulgt af en afkøling af løsningen.
Reaktivitet
Organisk syntetiske stoffer
Natriumborhydrid reducerer aldehyder og ketoner i alkoholer, såvel som de mere reaktive carboxylsyrederivater, acylklorider og thiol-estere. Men i modsætning til det kraftige reduktionsmiddel lithiumaluminiumhydrid, anvendes udelukkende NaBH4 grundet dets blide reaktion, som ikke vil reducere estere, amider, eller carboxylsyrer.
Stærkere reduktionsmidler kan genereres ved at destabilisere borhydrid. Dette er fundet i forbindelser som f.eks superhydrid (lithiumtriethylborhydrid) og L-Selectrid (lithium-tri-sec-butylborhydrid).
Andre reaktioner
Oxidation af NaBH4 med jod i tetrahydrofuran skaber et BH3-THF-kompleks, hvilket kan reducere carboxylsyrer. Ligeledes NaBH4-MeOH system, der dannes ved tilsætning af methanol til natriumborhydrid i refluxerende THF, reducerer estere til de tilsvarende alkoholer, for eksempel benzylbenzoat til benzylalkohol.
BH4- er fremragende for metalioner. Sådanne borhydrid-komplekser er ofte udarbejdet fra virkningen af NaBH4 (eller LiBH4) på de tilsvarende metalhalider, fx Zr(BH4)4.
Brændselsceller
Natriumborhydrid bruges også eksperimentelt i brændselscellesystemer. Som brændstof er det mindre brandfarligt og mindre omskifteligt end benzin, men mere ætsende. Det er relativt miljøvenligt grundet den lave toksicitet af borater. Brint er genereret for en brændselscelle ved katalytisk nedbrydning af den vandige borhydride opløsning:
NaBH4 + 2 H2O → NaBO2 + 4 H2 + varme
Helbred og sikkerhed
Natriumborhydride er et særlig farligt laboratoriereagens. Det er stærkt ætsende, og vil forårsage forbrændinger ved kontakt med alle områder af kroppen. Det er skadeligt ved indtagelse, indånding eller absorbering gennem huden. Det er brandfarligt og vil reagere med vand.
Toksicitet
Indånding af natriumborhydrid skader slimhinder og øvre luftveje. Symptomer på indånding omfatter irritation i mund, næse og hals og åndedrætsbesvær. Det kan også forårsage lungeødem, en potentielt dødelig akut vandophobning.
Indtagelse af natriumborhydrid kan forårsage alvorlige forbrændinger i mund, svælg og mave. Det kan også forårsage ondt i halsen, opkastning og diarré. Alvorlig hudirritation eller forbrændinger kan skyldes kontakt med våd natriumborhydride, eller fra kontakt med fugtig hud. Øjenkontakt med natriumborhydride kan forårsage synsforstyrrelser, rødme, smerter og svære vævforbrændinger.
Reaktivitet
Natriumborhydrid er meget reaktivt, og understøtter forbrændinger. Det er et brandfarligt tørstof, som kan antændes i luften under overværelse af en åben flamme, og vil fortsætte med at brænde indtil al brint er brændt. Det kan reagere med vand og damp til at producere brint, som er meget brandfarligt. En eksplosion kan forekomme ved en spontan antændelse af gasser, som frigives fra en mættet opløsning af natriumborhydrid i dimethylformamid ved 17 °C.
|
Medier brugt på denne side
Ball-and-stick model of part of the crystal structure of the α polymorph of sodium borohydride, NaBH4.
X-ray crystallographic data from Appl. Phys. Lett. (2005) 87, 261916.
Model constructed in CrystalMaker 8.1.
Image generated in Accelrys DS Visualizer.Ball-and-stick model of part of the crystal structure of the β polymorph of sodium borohydride, NaBH4.
X-ray crystallographic data from J. Phys. Chem. B (2007) 111, 13873–13876.
Model constructed in CrystalMaker 8.1.
Image generated in Accelrys DS Visualizer.Ball-and-stick model of part of the crystal structure of the γ polymorph of sodium borohydride, NaBH4.
X-ray crystallographic data from J. Phys. Chem. B (2007) 111, 13873–13876.
Model constructed in CrystalMaker 8.1.
Image generated in Accelrys DS Visualizer.Ball-and-stick model of the zirconium borohydride molecule, Zr(BH4)4








