Cellemembran

1. Glykolipid.
2. Polypeptidkæde.
3. Oligosakkarid.
4. Fosfolipid.
5. Membranprotein.
6. Transmembran alfa-helix.
7. Kolesterol.
Cellemembran eller plasmamembran er en biologisk membran, der adskiller det indre af en celle fra omgivelserne. Historisk er cellemembranen desuden blevet kaldt plasmalemma. Den består af et dobbeltlag af lipider med indlejrede proteiner. Lipidernes upolære carbonkæder gør cellemembranen gennemtrængelig for upolære molekyler og visse små molekyler som kuldioxid (CO2) og ilt (O2), men uigennemtrængelig for ioner og de fleste polære molekyler. Passage af ioner og polære molekyler er imidlertid mulig i kontrolleret omfang via forskellige typer transmembrane proteiner, f.eks. kanaler og transportproteiner (herunder biologiske "pumper" som natrium-kalium-pumpen). Cellemembranen medvirker til en række vigtige cellulære processer, f.eks. celleadhæsion og cellesignalering, og tjener som fæste for det intracellulære cytoskelet og vigtige ekstracellulære strukturer, heriblandt cellevæggen og glykocalyxen (en ydre beklædning af glykoproteiner, der medvirker ved celle-celle-genkendelse). Cellesignaleringen foregår ved hjælp af receptorer (modtagermolekyler), der gør cellen i stand til at reagere på specifikke signalstoffer, f.eks. hormoner.
Struktur
Hovedstrukturen i en cellemembran er lipiddobbellaget. Studiet af cellemembranens fysiske egenskaber kaldes for biomembranfysik.
Lipiddobbeltlaget
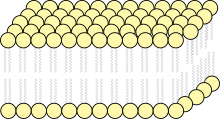
Biologiske membraner er opbygget af amfifile lipidmolekyler. De består af et polært hoved og en lang, upolær hale. Hovedparten af lipiderne i cellemembranen indeholder én eller flere umættede kæder, hvis dobbeltbinding giver dem et "knæk"; dette knæk giver det samlede lipid en cylinderform. Cylinderformede lipider har en tendens til at danne et dobbeltlag med hinanden, således at de polære hoveder vender mod vandsiden og de upolære haler mod mellemrummet mellem de to lag. Er der tilstrækkeligt mange lipider, slutter dobbeltlaget sig spontant sammen til den termodynamisk mest stabile form, dvs. en kugle. Dette er tilfældet for levende celler. Såvel de hydrofile vekselvirkninger ved membranens overflade som hydrofobe vekselvirkninger mellem lipidmolekylernes alifatiske dele i membranens indre er med til at stabilisere og binde strukturen sammen. En brist i dobbeltlaget vil normalt lukke sig af sig selv.
Generelt er lipiddobbeltlaget uigennemtrængeligt for polære molekyler. Dobbeltlagets hydrofobe indre forhindrer polære molekyler (f.eks. aminosyrer, nukleinsyrer, kulhydrater, proteiner og ioner) i at diffundere gennem membranen, men tillader generelt passiv diffusion af hydrofobe molekyler. Cellen kan dermed kontrollere passagen af hydrofile stoffer via transmembrane proteiner som kanaler og transportproteiner.
Flippaser og scramblaser koncentrerer det negativt ladede fosfolipid fosfatidylserin på indersiden af membranen. Sammen med sialinsyre skaber dette endnu en barriere for ladede partikler og molekyler, der passerer gennem membranen.
Flydende mosaik-modellen
Ifølge den såkaldte flydende mosaik-model foreslået af de amerikanske forskere Seymour Jonathan Singer og Garth L. Nicolson i 1972 kan biologiske membraner opfattes som en todimensionel væske, hvori en stor mængde lipider og proteiner flyder rundt mere eller mindre frit.[1] Vekselvirkninger mellem indlejrede membranproteiner og membranlipider giver anledning til protein-lipid-klynger, der bevæger sig rundt eller ”flyder” lateralt mellem hinanden – en flydende mosaik. Cellemembranens fluiditet afhænger af dens bestanddele og temperatur. Den store mængde proteiner i cellemembranen giver membranen en vis grad af struktur ved f.eks. at danne protein-protein-komplekser og "lipid rafts" (specialiserede mikrodomæner[2] i cellemembranen indeholdende store mængder membranproteiner, kolesterol og en type lipider kaldt glykosphingolipider).[3]
Bestanddele
Cellemembraner indeholder forskellige biomolekyler, først og fremmest lipider og proteiner. Stoffer optages i membranen eller fjernes fra den ved forskellige mekanismer:
- Fusion af intracellulære vesikler med membranen (exocytose) udskiller ikke blot vesiklens indhold, men integrerer også vesikelmembranens bestanddele i cellemembranen. Omvendt kan cellemembranen skille sig af med materiale ved at afsnøre dele af sig selv som vesikler.
- Hvis en membran er forbundet med en rørformet struktur lavet af membranmateriale, kan materialet fra røret trækkes ind i membranen.
- Skønt koncentrationen af membranbestanddele i de omgivende væskefaser er ringe (idet stabile membranbestanddele er tungtopløselige i vand), foregår der en udveksling af molekyler mellem lipid- og vandfasen.
Lipider

Cellemembranen består af tre klasser af amfifile lipider: fosfolipider, glykolipider og steroler (herunder kolesterol). Mængdeforholdet afhænger af celletype, men hos de fleste celler er fosfolipiderne de talrigeste.[4] Studier af røde blodlegemer har vist, at 30 % af deres cellemembraner udgøres af lipider.
Carbonkæderne i fosfolipiderne og glykolipiderne indeholder typisk et lige antal carbonatomer, som regel mellem 16 og 20. Fedtsyrekæder med 16 eller 18 carbonatomer er de almindeligste. Fedtsyrerne i et lipid kan enten være mættede eller umættede – de umættede er næsten altid på cis-formen. Længden og graden af umættethed af en fedtsyrekæde har vital betydning for lipidets rumlige opbygning og dermed membranens fluiditet,[5] idet umættede kæder danner et "knæk", der forhindrer fedtsyrerne i at pakke sig tæt sammen. Dette sænker lipidets smeltepunkt og øger membranens fluiditet. Kolesterol mindsker derimod fluiditeten, da kolesterol giver cellemembranen højere smeltepunkt ved at reducere lipidernes bevægelsesfrihed.
Hele cellemembranen holdes sammen af londonbindinger mellem de hydrofobe fedtsyrekæder. Lipiderne flyder dog frit mellem hinanden. Under fysiologiske forhold opfører fosfolipidmolekylerne i membranen sig som flydende krystaller. Det betyder, at lipidmolekylerne frit kan diffundere rundt mellem hinanden i samme lag. Derimod er det en langsom proces at springe fra lag til lag. "Lipid rafts" og caveolae (latin for "små hulrum") er eksempler på kolesterolrige mikrodomæner i cellemembranen.[3]
Kulhydrater
Cellemembraner indeholder kulhydrater, primært glykoproteiner og i mindre grad glykolipider (cerebrosider og gangliosider). På den intracellulære side sker der stort set aldrig glykosylering. Det gør der derimod på overfladen af cellen. Glykocalyxen er en tynd beklædning af kulhydratholdigt materiale omkring alle celler. Den spiller en vigtig rolle ved celleadhæsion, lymfocytrecirkulation samt andre celleinteraktioner.[6] Glykocalyxen består af oligosakkarider indeholdende sialinsyre, hvis negative ladning danner en udvendig barriere mod ladede partikler.
Proteiner

Omkring 50 % af cellemembranens volumen udgøres af protein.[5] Proteinerne udfører en række vigtige biologiske processer for cellen. Omtrent en tredjedel af gærsvampes gener koder specifikt for dem, og for multicellulære organismer er dette tal endda større.[4]
Cellemembranen er en vigtig kontaktflade for celle-celle-kommunikation. Den indeholder derfor receptor- og genkendelsesproteiner, der sørger for den fysisk-kemiske kommunikation mellem cellen og dens omgivelser, f.eks. antigener, på sin ydre overflade. Membranproteinerne kan også tjene til celle-celle-kontakt, overfladegenkendelse, cytoskeletkontakt, cellesignalering, enzymaktivitet eller transport gennem cellemembranen.
Transmembrane membranproteiner må integreres i cellemembranen. Normalt føres færdigsyntetiserede proteiner ind i lumen af det ru endoplasmatiske reticulum (RER) gennem en proteinkanal, men membranproteiner indeholder et sted i deres sekvens en kortere sekvens med ca. 20 hydrofobe aminosyrer.[7] Denne skal udgøre den transmembrane del af proteinet og virker som en stop-transfer-sekvens, der stopper overføringen af proteinet gennem proteinkanalen. Proteinet vandrer derefter bort fra kanalen og lægger sig i RER-membranen, hvorfra det kan transporteres til Golgiapparatet og videre til cellemembranen ved hjælp af vesikler.
| Type | Beskrivelse | Eksempel |
|---|---|---|
| Integrale (eller transmembrane) proteiner | Gennembryder lipiddobbeltlaget og har et hydrofilt cytosolært domæne, der er i kontakt med cellens indre overflade, et hydrofobt domæne, der er begravet i cellemembranen og hæfter proteinet til denne, og et hydrofilt ekstracellulært domæne, der er i kontakt med cellens ydre overflade. Det hydrofobe domæne kan bestå af én eller flere alfahelixer, og man taler da hhv. om "single-pass"- og "multipass"-proteiner, eller en "tønde" af beta-foldeblade (en sådan "β-barrel" – findes hos bakterier, mitokondrier og grønkorn[8]). | Ionkanaler, natrium-kalium-pumpen, H+-pumper, G-protein-koblede receptorer (GPCR), receptor-proteinkinaser |
| Lipidforankrede proteiner | Kovalent bundet til ét eller flere lipidmolekyler i cellemembranen. Proteinet selv er ikke i kontakt med membranen. | G-proteiner |
| Perifere proteiner | Bundet til integrale membranproteiner ved ikke-kovalente interaktioner. Disse proteiner interagerer typisk kun kortvarigt med cellemembranen. | Visse enzymer og hormoner |
Variationer
Visse celletypers cellemembraner har specifikke navne, hvilket afspejler en varierende lipid- og proteinsammensætning:
- Sarcolemma hos muskelceller
- Oolemma hos ægceller
- Axolemma hos neuronernes axoner
Funktion
Cellemembranen omgiver cellens cytoplasma og adskiller således de intracellulære komponenter fra det ekstracellulære miljø. Svampe, bakterier og planter har desuden en cellevæg, der yder cellen mekanisk støtte og forhindrer passage af større molekyler. Cellemembranen tjener også som fæste for cytoskelettet, der afstiver cellen indvendigt og opretholder dens form, og for den ekstracellulære matrix og andre celler, således at flere celler kan finde sammen og danne væv.
Stoftransport
Cellemembranen er selektivt permeabel (gennemtrængelig) og regulerer, hvad der passerer ind og ud af cellen. Passagen af stoffer gennem cellemembranen kan være passiv eller aktiv (energikrævende). Passagen af ladede partikler skaber sammen med tilstedeværelsen af negativt ladede fosfolipider på indersiden af membranen en spændingsforskel over membranen, cellens membranpotential, der varierer alt efter celletypen. Cellemembranen fungerer således som et selektivt filter, der kun tillader specifikke stoffer at komme ind eller ud. Transporten af stoffer gennem membranen foregår ved forskellige mekanismer:
- 1. Simpel diffusion og osmose: Nogle stoffer, f.eks. kuldioxid (CO2), ilt (O2) og vand (H2O), kan passere gennem membranens lipiddobbeltlag ved diffusion, som er en passiv proces. Fordi membranen fungerer som barriere for visse molekyler og ioner, kan disse forekomme i forskellige koncentrationer på hver side af membranen. En sådan koncentrationsforskel eller -gradient over en semipermeabel membran skaber et osmotisk tryk, der presser vandet i den retning, hvor koncentrationen er størst.
- 2. Faciliteret transport: Er ligesom diffusion drevet af en koncentrationsgradient, men foregår gennem kanaler eller ved hjælp af transportproteiner i membranen.
- 3. Pumper: Ioner, der skal transporteres ind eller ud af cellen imod en koncentrationsgradient, og store molekyler må transporteres gennem cellemembranen ved hjælp af såkaldte pumper, der forbruger energi fra cellen. Et eksempel på en sådan pumpe er natrium-kalium-pumpen (opdaget af Jens Christian Skou m.fl.), der pumper natriumioner (Na+) ud af cellen og kaliumioner (K+) ind i cellen. Transport via pumper er en form for aktiv transport.
- 4. Sekundært aktiv transport: Kemiske stoffer, der skal transporteres mod sin koncentrationsgradient, kan transporteres sammen med et andet stof, der bevæger sig med sin koncentrationsgradient, således at bevægelsen mod koncentrationsgradienten kan lykkes. Transporten af de to stoffer kan enten foregå i samme retning (symport) eller modsatrettet (antiport). Et eksempel på symport er transporten af glukose og natriumioner (Na+) ind i cellen ved hjælp af SGLT-2-cotransporteren (et transportprotein);[9] hver natriumion, der passerer ind i cellen med en koncentrationsgradient ved hjælp af transporteren, "medbringer" et glukosemolekyle, der bevæger sig imod sin koncentrationsgradient. Den energi, der frigives ved passage af natriumionen, bruges af glukosemolekylet til at overvinde gradienten. Der sker derved intet energitab ved transporten, men natriumionernes koncentrationsgradient må opretholdes ved hjælp af natrium-kalium-pumpen, der forbruger energi. Et eksempel på antiport er den samtidige transport af Na+-ioner ind i cellen og hydrogenioner (H+) ud af cellen ved hjælp af den såkaldte Na+-H+-antiporter (et andet transportprotein), som medvirker til at holde cytosolens pH-værdi på ca. 7,2.[10] Transporten af H+-ioner ud af cellen faciliteres af transporten af Na+-ioner ind i cellen pga. Na+-gradienten, som opretholdes af natrium-kalium-pumpen.
- 5. Endocytose: Ved endocytose omslutter en celle et molekyle og absorberer det. Cellemembranen danner en hulning indadtil (en invagination) hvori stoffet, der skal absorberes, fanges. Hulningen afsnøres derefter fra indersiden af membranen, hvilket skaber en vesikel, som indeholder stoffet. Absorption af faste partikler ved hjælp af endocytose kaldes også fagocytose, mens endocytose af væske (f.eks. vand), eventuelt med opløste ioner, kaldes pinocytose.[11] Endocytose kræver energi og er således en form for aktiv transport.
- 6. Exocytose: Ligesom et stof kan transporteres ind i cellen ved invagination og dannelse af en vesikel, kan en vesikel fusionere med cellemembranen og afgive sit indhold til omgivelserne. Denne proces kaldes exocytose. Celler benytter exocytose bl.a. til at skille sig af med ufordøjede rester af stoffer, der er blevet ført ind ved endocytose, og til at udskille hormoner, neurotransmittere (for neuroners vedkommende) eller enzymer. Ved exocytose afsnøres en vesikel eller en vakuole fra Golgiapparatet, hvorefter den transporteres fra cellens indre til indersiden af cellemembranen via cytoskelettet. Her kommer vesikelmembranen i kontakt med cellemembranen. Lipidmolekylerne i de to dobbeltlag rearrangeres, hvorved de to membraner fusionerer. Dette fører til en åbning i den fusionerede membran, hvorigennem vesikelindholdet tømmer sig.
Celleadhæsion og cellesignalering
Cellemembraner kan danne forskellige “supramembranøse” strukturer som caveolae, fokale adhæsioner og forskellige typer celle-celle-forbindelser som desmosomer. Disse strukturer er typisk ansvarlige for celleadhæsion, kommunikation, endocytose og exocytose. De kan påvises ved elektronmikroskopi eller fluorescensmikroskopi. De består af celleadhæsionsmolekyler, f.eks. neuralcelleadhæsionsmolekyler (NCAM), integriner og cadhæriner.
Celleforankring
Forankringsproteiner kobler naboceller sammen, og kan have forskellige udseende og funktion. Desmosomer giver trækkraft, og evne til at modstå stor mekanisk stress, f.eks hudens væv.
Tight junctions kobler naboceller tæt sammen, for at forhindre at stoffer kan passere mellem cellerne, og danner altså en effektiv barriere. Fordøjelsessystemets væv har mange steder tight junctions der har den rolle at sørge for at passagen af næringsstoffer kan reguleres, ved at sørge for at stofferne transporteres direkte fra den apikale overflade, intracellulært gennem cellen, for bagefter at transporteres ud ved basalmembranen.
Gap junctions er intercellulære forbindelser der direkte forbinder cellers cytoplasma, og tillader transport af ioner, molekyler, og endda elektriske impulser. Et godt eksempel er i hjertemuskelcellerne, hvor gap junctions sørger for at myocardiet kontrakter synkront.[12]
Cytoskelettet
Proteiner i cellemembranen tjener som fæste for cellens cytoskelet. Cytoskelettet findes under cellemembranen og udgør et indre stillads for cellen. Cytoskelettet danner desuden cilier og mikrovilli. Cilier (eller fimrehår) er bevægelige udløbere med et indre kompleks af mikrotubuli, der udvendigt er dækket af cellemembranen. I luftvejene medvirker cilier til at fjerne støvpartikler og mikroorganismer fanget i slimlaget.[13] Mikrovilli er fingerlignende udløbere i cellemembranen på visse epitelcellers frie overflade (især i tarmen). Deres formål er at øge overfladearealet, hvilket øger absorptionen af næringsstoffer.
Prokaryoter
Gram-negative bakterier har både en cellemembran og en ydre membran adskilt af et periplasmatisk mellemrum. Andre prokaryoter har kun en cellemembran. Prokaryoter er også omgivet af en cellevæg bestående af peptidoglycaner (aminosyrer og kulhydrater). Visse eukaryoter (svampe- og planteceller) har også cellevægge, som dog ikke består af peptidoglycaner.
Se også
Referencer
- ^ Singer SJ, Nicolson GL (februar 1972). "The fluid mosaic model of the structure of cell membranes". Science. 175 (4023): 720-31. doi:10.1126/science.175.4023.720. ISSN 0036-8075. PMID 4333397. (engelsk)
- ^ Alberts, Bruce, et al. Molecular Biology of the Cell, 5. udgave, p. 625. USA: Garland Science, 2008. ISBN 978-0-8153-4106-2. (engelsk)
- ^ a b Alberts, Bruce, et al. Molecular Biology of the Cell, 5. udgave, p. 790. USA: Garland Science, 2008. ISBN 978-0-8153-4106-2. (engelsk)
- ^ a b Lodish H, Berk A, Zipursky LS; et al. (2004). Molecular Cell Biology (4th udgave). New York: Scientific American Books. ISBN 0-7167-3136-3.
{{cite book}}: Eksplicit brug af et al. i:|author=(hjælp)CS1-vedligeholdelse: Flere navne: authors list (link) (engelsk) - ^ a b Jesse Gray, Shana Groeschler, Tony Le, Zara Gonzalez (2002). "Membrane Structure" (SWF). Davidson College. Hentet 2007-01-11.
{{cite web}}: CS1-vedligeholdelse: Flere navne: authors list (link) (engelsk) - ^ Geneser, Finn, et al. Genesers histologi, 1. udgave, p. 69. København: Munksgaard, 2012, ISBN 978-87-628-0396-1.
- ^ Geneser, Finn, et al. Genesers histologi, 1. udgave, pp. 75-76. København: Munksgaard, 2012, ISBN 978-87-628-0396-1.
- ^ Alberts, Bruce, et al. Molecular Biology of the Cell, 5. udgave, p. 635. USA: Garland Science, 2008. ISBN 978-0-8153-4106-2. (engelsk)
- ^ Blaustein, Mordecai P., Joseph P.Y. Kao og Donald R. Matteson. Cellular Physiology and Neurophysiology, 2. udgave, p. 121. USA: Elsevier-Mosby, 2012, ISBN 978-0-3230-5709-7. (engelsk)
- ^ Alberts, Bruce, et al. Molecular Biology of the Cell, 5. udgave, p. 657. USA: Garland Science, 2008. ISBN 978-0-8153-4106-2. (engelsk)
- ^ Geneser, Finn, et al. Genesers histologi, 1. udgave, pp. 90-91. København: Munksgaard, 2012, ISBN 978-87-628-0396-1.
- ^ Nielsen, O.F., Bojsen-Møller, M.J. 2022. Anatomi og fysiologi (2 udg.) Munksgaard. p. 24-29
- ^ Geneser, Finn, et al. Genesers histologi, 1. udgave, p. 182. København: Munksgaard, 2012, ISBN 978-87-628-0396-1.
Eksterne henvisninger
- Se "Cellemembranen – nogle væsentlige egenskaber" Arkiveret 29. september 2015 hos Wayback Machine for en forenklet model af en cellemembran.
Medier brugt på denne side
Example of primary active transport, where energy from hydrolysis of ATP is directly coupled to the movement of a specific substance across a membrane independent of any other species. Image renamed from Image:Sodium-Potassium_pump.svg
Forfatter/Opretter: Jerome Walker, Licens: CC BY 2.5
Fluid Mosaic model of cell membrane
Forfatter/Opretter: Vektorisering: Hbf878, Licens: CC0
Scheme of the general structures of membrane phospholipids and glycolipids.
Forfatter/Opretter: unknown, Licens: Attribution