Limonen
| Limonen | |
|---|---|
 | |
| Generelt | |
| Systematisk navn | 1-methyl-4-prop-1-en-2-yl- cyclohexene |
| Andre navne | 4-isopropenyl-1-methyl- cyclohexene Racemisk: DL-limonene; dipentene |
| Molekylformel | C10H16 |
| Molmasse | 136.24 g/mol |
| Fremtræden | klar, farveløs væske |
| CAS nummer | [138-86-3] |
| SMILES | CC1=CCC(C(=C)(C))CC1 |
| Egenskaber | |
| Massefylde | 0.8411 g/cm3 |
| Smeltepunkt | -95 °C |
| Kogepunkt | 176 °C |
| Sikkerhed | |
| R-sætninger | R10, R38, R43, R50/53 |
| S-sætninger | S24, S37, S60, S61 |
| Flammepunkt | 50°C |
| Hvis ikke andet er angivet, er data givet for stoffer i standardtilstanden (ved 25 °C, 100 kPa) | |
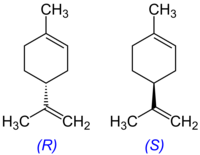
Limonen er en alifatisk organisk forbindelse, der klassificeres som en terpen. Ved stuetemperatur er det en klar, farveløs væske med en kraftig duft af appelsin. Navnet stammer fra engelsk: lemon (citron), da denne frugt, i lighed med andre citrusfrugter, har et højt indhold af limonen i skallen. Limonen er således ansvarlig for den karakteristiske citrusduft. Limonen er et kiralt molekyle, og i biologiske kilder produceres kun en specifik enantiomer. Citrusfrugter indeholder d-limonen ((+)-limonen), som er (R)-enantiomeren (CAS nummer 5989-27-5). Racemisk limone kaldes også dipenten.
Brug
Den naturlige enantiomer fra citrusfrugter (Rutaceae), d-limonen, bruges i fødevarebranchen som smagsaroma. Det kan findes i frugtjuice, sodavand, bagværk, is og budding. Det er et populært tilsætningsstof i sæber, vaskemidler, rengøringsmidler, parfume og deodoranter og mange andre skønhedsprodukter.
Limonen bruges ofte som et miljøvenligt alternativ til mineralolie til f.eks. at fjerne olie fra maskindele, da det er lettere nedbrydeligt i naturen end mineralolier, og nemt at producere fra miljøvenlige kilder.
(R)-enantiomeren bruges som botanisk insecticid.
(S)-enantiomer, også kaldet l-limonene (CAS nummer 5989-54-8, EINECS nummer 227-815-6), bruges som duft i rengøringsmidler. I modsætning til d-limonens citrusduft, har l-limonen en terpentin-agtig lugt.
Kemi
Limonen er en relativt stabil terpen, som kan destilleres uden at dekomponere. I forbindelse med varmt metal danner den isopren. Den oxideres nemt i fugtig luft til carveol og carvon. Ved oxidation med svovl dannes der p-cymen og sulfider.
Limonen forekommer naturligt som (R)-enantiomer, men kan racemiseres til dipenten ved opvarmning til 300 °C. Når den opvarmes sammen med mineralsyrer dannes den konjugerede dien terpenin, som spontant oxideres p-cymen, en aromatisk kulstofforbindelse.
Biosyntese
I naturen syntetiseres limonen fra geranylpyrofosfat, via cyclisation af en nerylcarbokation eller tilsvarende. Det sidste trin i syntesen involverer tab af en proton fra kationen, og der dannes en alken.

Sikkerhed
Limonen og dets oxidationsprodukter kan give hudirritation, og limonen-1,2-oxid (dannes ved oxidation med luft) øger hudens følsomhed. Overfølsomhed er hyppigst observeret efter længere tids påvirkning
Limonen fremkalder nyrekræft i hanrotter, men ikke i hverken hunrotter eller mus af begge køn. Dette skyldes at nedbrydningsproduktet limonen-1,2-oxid binder sig til proteinet α2u-globulin, som kun produceres af hanrotter. Der er ikke fundet bevis for at limonen skulle være kræftfremkaldende for mennsker.
Eksterne henvisninger
- Detaljeret beskrivelse af d-limonene fra Biochem Corp. Arkiveret 24. september 2005 hos Wayback Machine
Medier brugt på denne side
Forfatter/Opretter: Fred the Oyster, Licens: CC BY-SA 4.0
The biosynthesis of limonene
Limonene enantiomers, structure formula

