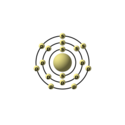Klor
| Klor | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 gulgrøn | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Periodiske system | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Generelt | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomtegn | Cl | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomnummer | 17 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronkonfiguration | 2, 8, 7 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gruppe | 17 (halogen) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Periode | 3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Blok | 9 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS-nummer | 7782-50-5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomare egenskaber | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atommasse | 35,453(2) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomradius | 100 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kovalent radius | 99 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Van der Waals-radius | 175 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronkonfiguration | [Ne] 3s² 3p5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektroner i hver skal | 2, 8, 7 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kemiske egenskaber | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidationstrin | ±1, 3, 5, 7 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronegativitet | 3,16 (Paulings skala) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fysiske egenskaber | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tilstandsform | gas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Krystalstruktur | ortorhombisk | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Massefylde (gas) | 3,2 g/L | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Smeltepunkt | −101,5 °C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kogepunkt | −34,04 °C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kritisk punkt | 143,75 °C, 7,991 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Smeltevarme | (Cl2) 6,406 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fordampningsvarme | (Cl2) 20,41 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Varmefylde | (Cl2) 33,949 J·mol–1K–1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Varmeledningsevne | 8,9 mW/(m⋅K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetiske egenskaber | ikke magnetisk | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Information med symbolet | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Klor eller chlor (fra latin chlorum) (fra græsk: Xλώριο=chlorós gulligt-grøn) er et grundstof, som er gasformig under normalbetingelser (1,013 bar, 0 °C).
Klor lugter stikkende og er klassificeret som farlig stof.
Det gulgrønne klor er noget opløseligt i vand, den vandige opløsning kaldes klorvand. Klor optager nemt elektroner og egner sig derfor godt som oxidationsmiddel. I industrien bliver klor nu om dage tit erstattet af det mindre miljøskadelige og nemmere håndterbare stof H2O2 (Hydrogenperoxid).
Klor kan ikke brænde, men er et af de mest reaktive grundstoffer. Dette skyldes dets elektronegativitet i forhold til de andre grundstoffer, og har derfor en stilling mod højre i det periodiske system. Det reagerer allerede ved normalbetingelser med talrige andre grundstoffer, mange organiske og uorganiske forbindelser, og tit ret kraftigt under stærk varmefrigivelse (eksoterme reaktioner).
Klor danner sammen med natrium almindelig natriumklorid (NaCl).
Biologi
Fysiologisk har klor en stor betydning som negativ modion til positive ioner og optages overvejende gennem føden i form af køkkensalt (NaCl). Biologisk vigtigst er dannelsen af mavesyre og opretholdelse af osmosefunktionerne i kroppen.
Mange pesticider er organiske klorforbindelser: Hexachlorbenzen (også kaldet HCB, perchlorbenzen eller PCB) DDT, dicofol, heptachlor, endosulfan, chlordane, aldrin, dieldrin, endrin, mirex og pentachlorophenol. Mange af disse pesticider er blevet forbudt ifølge Stockholm Konventionen af 2001 om persisterende pesticider og andre organiske forurenere [1] For nærværende er neonikotinoidet imidacloprid det mest anvendte insekticid i verden, men er fra 1. december 2013 forbudt at anvende i EU i en periode af to år.
Toksikologi og anvendelse som krigsgas
Klor er stærkt oxiderende og reagerer kraftigt med mange stoffer, hvilket kan være ekstremt skadeligt for mennesker og dyr. Da klor ved normale temperaturer er en gas, kan den nemt indåndes og kommer nemt i kontakt med øjnene, hvor den bl.a. reagerer med vanddamp i lungerne og i øjnene. Herved opstår syre, der virker lokalirriterende eller – i tilstrækkelig høj koncentration – akut ætsende.[2]
Klor blev indsat som giftgas under Første Verdenskrig, hvorved 2000 britiske soldater omkom og yderligere 165.000 blev sårede ifølge en undersøgelse (se også Giftgas i 1. verdenskrig). Mennesker er blevet udsat for klor i farlige mængder ved vej- og jernbaneulykker og ved fejldosering i svømmebassiner. I papirindustrien anvendes/anvendtes klor til blegning og nogle medarbejdere er blevet syge af langtidspåvirkning af klor i mindre koncentrationer.[2]
Fremstilling af klor
- Reaktion af Kaliumpermanganat med koncentreret saltsyre
- Elektrolyse af NaCl-opløsning
Forbindelser med klor
- Trichloramin, Klortrifluorid
- Syrer: Klorundersyre, saltsyre
- Salte: Kaliumklorid, natriumchlorid, natriumhypoklorit (NaClO), klorin
- PVC
- CFC-gasser, HCFC-gasser, Kloroform
- Hexachlorbenzen, PCB, dioxin
- Sennepsgas
- Klorhexidin
- Bekæmpelsesmiddel, pesticider, insekticider: Neonikotinoidet imidacloprid, DDT, Agent Orange, 2,4,5-T, 2,4-D, MCPA eller 2-methyl-4-chlorophenoxy-eddikesyre, tolylfluanid, chlormequat, chlormequatchlorid, chlorcholinchlorid, CCC ([2-klorethyl]-trimethylammoniumklorid),
- Sukralose
- Medicin: Amlodipin, Klorprotixen, Ketogan
- Antibiotika: Clometocillin, Cloxacillin, klorotetracyklin
Firmaer der fremstiller klorforbindelser
Se også
Eksterne henvisninger
| Wikimedia Commons har medier relateret til: |
- January 07 2005, iol: Pollution-eating bugs found in sewage sludge Arkiveret 13. januar 2005 hos Wayback Machine Citat: "...Different strains break down perchloroethylene or PCE, a chlorinated solvent used for dry cleaning; trichloroethylene, used to clean metal parts; chlorobenzenes, used to produce the now-banned pesticide DDT; and polychlorinated biphenyls or PCBs, compounds that were once used as coolants and lubricants in transformers..."
Reference
- ^ "Stockholm Convention on Persistent Organic Pollutants website". Arkiveret fra originalen 16. april 2014. Hentet 31. oktober 2010.
- ^ a b PDF-filen "Toxicological Overview" fra http://www.hpa.org.uk/Topics/ChemicalsAndPoisons/CompendiumOfChemicalHazards/Chlorine/
|
Medier brugt på denne side
(c) Peo at the Danish language Wikipedia, CC BY-SA 3.0
Denne tegning forestiller elektronkonfigurationen i et kloratom: Den store kugle i midten forestiller atomkernen, og de små kugler er elektronerne. Bogstaverne på elektron-kuglerne angiver hvilken orbital de tilhører. Den gule farve markerer at klor hører til halogenerne. Udarbejdet af Peo, og frigivet under samme GFDL-betingelser som Wikipedia som helhed.