Kiralitet (kemi)
 For alternative betydninger, se Kiralitet. (Se også artikler, som begynder med Kiralitet)
For alternative betydninger, se Kiralitet. (Se også artikler, som begynder med Kiralitet)
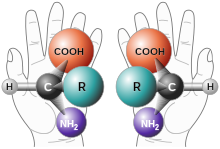
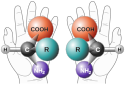
Kiralitet i kemien er det fænomen, at to molekyler er hinandens spejlbilleder (enantiomerer), men ellers opbygget af helt de samme kemiske grupper. Ordet kiral kommer af "cheiros", der på græsk betyder hånd – højre og venstre hånd er spejlbilleder af hinanden – de er kirale.
Ved kemiske reaktioner, der fører til dannelsen af et kiralt produkt, dannes de to spejlbilledformer/enantiomerer ikke nødvendigvis i et 1:1 forhold, og man taler da om forskellige grader af enantioselektivitet. I kemilaboratoriet bruges katalysatorer (typisk metalkomplekser) der fremmer en hurtigere reaktion og dannelsen af den ønskede (ene) form; de forhindrer samtidig dannelsen af den anden.
Nomenklatur
Der anvendes forskellige nomenklaturer til angivelse af den rumlige form af et kiralt molekyle:
- D,L-systemet: Dette system bruges hovedsageligt om kulhydrater og aminosyrer. 'D' er en forkortelse for dexter (latin højre), og 'L' er en forkortelse for laevus (latin venstre). Hvorvidt et kiralt molekyle er i sin D- eller L-form bestemmes ud fra molekylets Fischer-projektion.
- R,S-systemet: I dette system nummereres de fire kemiske grupper bundet til et kiralt center efter prioritet (jo højere atomvægt, desto højere prioritet). Når de tre højest prioriterede grupper træffes i rækkefølgen højest til lavest, når den fjerde og laveste gruppe peger indad, og man bevæger sig med uret, betegnes molekylet R (rectus, latin for højre). Bevæger man sig mod uret, betegnes molekylet S (sinister, latin for venstre).[1]
Kiralitet i naturen
I levende organismer dannes kun den ene af de to spejlbilledformer. Det gælder for eksempel proteiner og DNA . Hvis der var en blanding af begge udgaver, ville DNA ikke kunne være en spiral, der er formet af nukleotid-byggestenene; sukker (i D udg./form) og aminosyrer (i L udg./ form). Hvad der kan være årsag er, hvis ikke en tilfældighed, så et mysterium.
Når naturen danner biologisk materiale, er det enzymer, der formidler og kun tillader dannelsen af den ene form.
Kirale lægemidler
Eksempel på at to udgaver af et molekyle ikke har samme egenskaber viste sig at være katastrofal for lægemidlet Thalidomid. I 1960'erne blev det ordineret til gravide mod kvalme med videre. Det var syntetisk fremstillet og indeholdt begge spejlbilledformer. Den ene havde den ønskede virkning, mens den anden viste sig at hindre udviklingen af arme og ben hos det ufødte foster.[kilde mangler]
Referencer
- ^ Bruice, Paula Yurkanis. Organic Chemistry, 7th edition, pp. 155-157. Pearson, 2013, ISBN 978-0-321-85310-3. (engelsk)
Litteratur
- Jacob Thorhauge. 'Kemi i 3D'. Aktuel Naturvidenskab, år 2000, nr. 3, side 22-25.
Medier brugt på denne side
Amino Acid Chirality chirality with hands from http://www.nai.arc.nasa.gov/ A "chiral" molecule is one that is not superposable with its mirror image. Like left and right hands that have a thumb, fingers in the same order, but are mirror images and not the same, chiral molecules have the same things attached in the same order, but are mirror images and not the same. Although most amino acids can exist in both left and right handed forms, Life on Earth is made of left handed amino acids, almost exclusively. No one knows why this is the case. However, Drs. John Cronin and Sandra Pizzarello have shown that some of the amino acids that fall to earth from space are more left than right. Thus, the fact that we are made of L amino acids may be because of amino acids from space. Why do amino acids in space favor L? No one really knows, but it is known that radiation can also exist in left and right handed forms. So, there is a theory called the Bonner hypothesis, that proposes that left handed radiation in space (from a rotating neutron star for example) could lead to left handed amino acids in space, which would explain the left handed amino acids in meteorites. This is still speculative but our paper makes it much more plausible. In fact, this observations was one of the main reasons why we pursued this research. Although there were theories about how the amino acids could form in space in the ice, no one had shown that it was viable to make amino acids this way, until now.