Ædelgas
En ædelgas er et grundstof i gruppe 18 (tidligere kendt som ottende hovedgruppe) i det periodiske system. Disse grundstoffer, karakteriseret som ikke-metalliske og kemisk inaktive, er gasser ved standardbetingelser. De fem ædelgasser, der har stabile isotoper er helium (He), neon (Ne), argon (Ar), krypton (Kr) og xenon (Xe). Ædelgassen radon (Rn) er radioaktiv; grundstoffet er af den grund blevet undersøgt mindre end de første fem medlemmer af gruppen. Et formodet medlem af gruppen, oganesson (Og), er også blevet fremstillet, men meget lidt vides om dets egenskaber, hvilket skyldes dets ekstremt korte halveringstid.
Kemisk er ædelgasserne meget stabile grundet det maksimale antal valenselektroner, de indeholder i deres yderste skal, og som et resultat af dette reagerer de sjældent med andre grundstoffer. Under standardbetingelser er de lugtfrie, farveløse, monoatomare gasser. Smelte- og kogepunkter for hver ædelgas er tæt på hinanden og afviger kun med 10 °C; som konsekvens heraf er de kun væsker over et lille temperaturinterval. Ædelgasserne viser ekstremt begrænset kemisk reaktivitet, og derfor er kun nogle få hundrede ædelgasforbindelser blevet dannet frem til år 2008.
Neon, argon, krypton og xenon udvindes fra luft ved brug af metoder for fortætning af gasser og fraktionsdestillation. Helium separeres typisk fra naturgas, og radon isoleres som oftest fra radioaktivt forfald af dissocierede radiumforbindelser. Ædelgasser har flere vigtige anvendelser i industrier så som belysning, svejsning og rumforskning. Helium bruges ofte i SCUBA-dykkerudstyr til at erstatte en del af vejrtrækningsblandingen. Efter risikoen forårsaget af den lette antændelse af hydrogen blev anerkendt, blev dette grundstof erstattet af helium i luftskibe og balloner.
Historie
Ædelgas er oversat fra det tyske navneord Edelgas, først brugt i 1898 af Hugo Erdmann[1] til at referere til den ekstremt begrænsede reaktivitet, som de fleste af grundstofferne i gruppe 18 i det periodiske system udviser under standardbetingelser. Ædelgasserne er også blevet refereret til som inerte gasser, men dette er et ukorrekt mærkat, fordi flere af dem deltager i kemiske reaktioner.[2] Sjældne gasser er en anden term, der blev brugt,[3] men dette er også ukorrekt, fordi argon udgør en forholdsvis stor del (0,94% volumenmæssig, 1,3% af masse) af Jordens atmosfære.[4]

Pierre Janssen og Joseph Norman Lockyer var de første til at opdage en ædelgas den 18. august 1868, mens de kiggede på Solens kromosfære. De gav den navnet helium efter det græske navn for solguden, Helios (ἥλιος).[5] Før dem, i 1784, havde den engelske kemiker og fysiker Henry Cavendish opdaget, at luft indeholder en lille mængde af en substans, der er mindre reaktiv end nitrogen.[6] Et århundrede senere, i 1895, opdagede Lord Rayleigh, at prøver af nitrogen fra luften havde en anden densitet end nitrogen udvundet ved kemiske reaktioner. Lord Rayleigh teoretiserede sammen med videnskabsmanden William Ramsay, at nitrogen ekstraheret fra luft var blandet med en anden gas, hvilket ledte til et eksperiment, som succesfuldt isolerede et nyt grundstof, argon, navngivet efter det græske ord for inaktiv (αργό(ν)).[6] Med denne opdagelse indså de at en hel klasse af gasser manglede i det periodiske system. Ramsay formåede også at udskille helium for første gang, ved at opvarme mineralet cleveit. Dmitri Mendeleev godtog beviserne for eksistensen af helium og neon, og føjede dem i 1902 til sin forløber for det moderne periodiske system i en særlig "gruppe nul".[7]
Ramsay fortsatte sin søgen efter disse gasarter ved at destillere flydende luft i talrige fraktioner. I 1898 fandt han krypton, neon og xenon, og navngav dem efter de græske ord κρυπτός (kryptos, "skjult"), νέος (neos, "ny") og ξένος (xenos, "fremmed"). Radon blev opdaget af Ernest Rutherford i 1899.[8] Friedrich Ernst Dorn som også ofte krediteres for opdagelsen, citerer Rutherfords resultater i sit arbejde fra 1900.[9][10] Det blev omtalt som radium-udstråling, men blev ikke betragtet som en ædelgas, før man i 1904 fandt ud af at det har egenskaber der minder om de andre ædelgasser.[11] Rayleigh og Ramsay modtog Nobelpriser i henholdsvis fysik og kemi i 1904 for deres opdagelse af ædelgasserne;[12][13] ifølge den daværende præsident for det Kongelige Videnskabelige Selskab i Uppsala J.E. Cederblom, var "opdagelsen af en helt ny gruppe af grundstoffer, hvoraf intet medlem forinden var kendt med nogen som helst sikkerhed, noget fuldstændig unikt i kemiens historie, og er i sig selv et videnskabeligt fremskridt af særlig betydning".[13]
Opdagelsen af ædelgasserne hjalp kemikerne med at forstå atomets struktur. I 1895 forsøgte den franske kemiker Henri Moissan at få fluor, det mest elektronegative grundstof, til at gå i forbindelse med ædelgassen argon, men uden held. Først i slutningen af det 20. århundrede skulle det lykkes videnskaben at fremstille argonforbindelser, men alle disse forsøg var med til at opbygge teorierne for atomernes struktur. Det var også ud fra de negative resultater af disse forsøg, at den danske fysiker Niels Bohr i 1913 fremsatte teorien om at atomernes elektroner er ordnet i skaller rundt om den centrale atomkerne: Hos alle ædelgasserne, undtagen helium, har den yderste elektronskal otte elektroner.[11] I 1916 fremsatte Gilbert N. Lewis den såkaldte oktetregel, som fastslår at otte elektroner i yderste elektronskal er den mest stabile for ethvert atom, og da ædelgasserne "i sig selv" har netop dette antal, er disse stoffer temmelig uvillige til at indgå i reaktioner med andre atomer.[14]
Først i 1962 lykkedes det Neil Bartlett at påvise den første kemiske forbindelse med en ædelgas, xenonhexafluoroplatinat,[15] og snart efter opdagedes flere andre ædelgasforbindelser: Samme år, 1962, påviste man radonfluorid,[16] og i 1963 kryptondifluorid (KrF2).[17] Den første stabile argonforbindelse (argonhydrofluorid, HArF) blev skabt i 2000 ved en temperatur på 40K.[18]
I december 1998 lykkedes det videnskabsfolk ved det Forenede Institut for Kerneforskning i Dubna i Rusland at fremstille ét enkelt atom af grundstof nummer 114, ved at bombardere en plutonium-prøve med calcium-atomkerner;[19] dette stof fik i 2012 navnet flerovium (Fl).[20] Tidlige eksperimenter tydede på, at dette stof kan være det første supertunge grundstof der udviser usædvanligt "ædelgas-agtige" egenskaber, selv om det hører til gruppe 14 i det periodiske system.[21] I oktober 2006 samarbejdede det Forenede Institut for Kerneforskning med Lawrence Livermore National Laboratory om et forsøg, hvorunder det lykkedes at syntetisere ununoctium; grundstof nummer 118, og det syvende medlem af ædelgassernes gruppe.[22] I dette forsøg blev en prøve af californium "beskudt" med calcium-kerner.[23]
Fysiske og atomare egenskaber
| Egenskab[11][24] | Helium | Neon | Argon | Krypton | Xenon | Radon |
|---|---|---|---|---|---|---|
| Massefylde (g/dm³) | 0,1786 | 0,9002 | 1,7818 | 3,708 | 5,851 | 9,97 |
| Kogepunkt (K) | 4,4 | 27,3 | 87,4 | 121,5 | 166,6 | 211,5 |
| Smeltepunkt (K) | 0,95[25] | 24,7 | 83,6 | 115,8 | 161,7 | 202,2 |
| Fordampningsvarme (kJ/mol) | 0,08 | 1,74 | 6,52 | 9,05 | 12,65 | 18,1 |
| Opløselighed i vand ved 20 °C (cm3/kg) | 8,61 | 10,5 | 33,6 | 59,4 | 108,1 | 230 |
| Atomnummer | 2 | 10 | 18 | 36 | 54 | 86 |
| Atomradius (pm) | 130 | 160 | 192 | 198 | 218 | – |
| Ioniseringsenergi (kJ/mol) | 2.372 | 2.080 | 1.520 | 1.351 | 1.170 | 1.037 |
Under normale tryk- og temperaturforhold optræder alle ædelgasser som monoatomare gasarter; også de ædelgasser der har molmasser større end talrige molekyler af faste stoffer.[11] De meget svage kræfter der virker mellem atomer af ædelgasser, gør at alle disse stoffer har meget lave smelte- og kogepunkter.
Helium har en række usædvanlige egenskaber sammenlignet med andre grundstoffer: Det har de laveste smelte- og kogepunkter blandt samtlige kendte stoffer, og er det eneste grundstof der udviser superfluiditet. Helium er dertil det eneste grundstof der ikke kan fryses til et fast stof ved normalt atmosfærisk tryk; dertil kræves 25 atmosfæres tryk og en temperatur på 0,95K[26].
Ædelgasserne til og med xenon har talrige stabile isotoper: Den mest "langlivede" isotop af den næste ædelgas, radon, er 222Rn med en halveringstid på 3,8 døgn. Den henfalder til helium og polonium, som på lang sigt ender med at henfalde til bly.[11]

Som i de fleste andre grupper stiger ædelgassernes atomradier ned gennem perioderne, af den grund at der skal være plads til flere elektroner i de tungere atomer. Størrelsen på et atom har en indflydelse på en række af atomets egenskaber: For eksempel aftager ioniseringspotentialet med stigende radius, fordi valenselektronerne i de større ædelgas-atomer er længere væk fra atomkernen, og derfor ikke holdes nær så hårdt fast i atomet. Inden for hver enkelt periode har ædelgassen et af de største ioniseringspotentiale for alle grundstofferne i den pågældende periode, hvilket hænger sammen med stabiliteten i ædelgassernes elektronkonfiguration, og med disse gassers begrænsede kemiske reaktivitet.[24] Dog har de tungeste ædelgasser et så lavt ioniseringspotentiale, at det kan sammenlignes med andre grundstoffer og molekyler: Det var opdagelsen af at xenon har et ioniseringspotentiale af samme størrelsesorden som molekylær ilt, som fik Barlett til at forsøge at oxidere xenon ved hjælp af platinhexafluorid; et iltningsmiddel der vides at være stærkt nok til at reagere med ilt.[15] Ædelgasser kan ikke optage en elektron og dermed danne en stabil anion; de har en negativ elektronaffinitet.[27]
Ædelgassernes makroskopiske, fysiske egenskaber dikteres hovedsageligt af de svage van der Waals-kræfter atomerne imellem. Tiltrækningen mellem atomerne stiger med atomets størrelse, dels som en konsekvens af de større atomers lavere ioniseringspotentiale, dels fordi større atomer er lettere at polarisere. Dette viser sig som en systematisk tendens i gruppen af grundstoffer; Jo længere ned i gruppen man kigger, desto større atomradius, desto større virkning har de interatomare kræfter, og desto højere bliver ædelgassernes smelte- og kogepunkter, fordampningsvarme og opløselighed. Tendensen til stigende massefylde hænger direkte sammen med de stigende atomvægte.[24]
Ædelgasserne "opfører" sig nærved ideelt under standardbetingelser, men netop deres afvigelser fra idealgasligningen var vigtige spor i studiet af intermolekylære kræfter. Det såkaldte Lennard-Jones-potentiale, der ofte bruges til at beskrive de intermolekylære kræfter, blev beregnet af John Lennard-Jones i 1924 ud fra målinger udført på argon – før kvantemekanikken og dens grundlæggende beskrivelse af de intermolekylære kræfter.[28] Udviklingen af teorierne for disse kræfter blev lettet af de monoatomare ædelgassers kuglerunde atomer; dette forhold gør beregningerne isotropiske; uafhængige af atomernes retninger i forhold til hinanden.
Kemiske egenskaber
Ædelgasserne udgør gruppe 18 i det periodiske system. De vedtagne medlemmer er helium (He), neon (Ne), argon (Ar), krypton (Kr), xenon (Xe) og radon (Rn).[29] Disse grundstoffer er farveløse, lugtfrie, smagsløse og ikkeantændelige under standardbetingelser. De blev tidligere angivet som hovedgruppe 8 i det periodiske system, på grund af antallet af valenselektroner, og endnu før dette blev de angivet som gruppe 0, da man mente, at deres reaktivitet var nul og deres atomer ikke kunne kombineres med andre grundstoffers atomer i dannelsen af kemiske forbindelser. Det blev dog senere opdaget, at nogle af ædelgasserne alligevel danner forbindelser, hvilket fik forkastet "gruppe 0"-mærkatet.[11] Meget lidt vides om egenskaberne af det nyeste medlem af gruppe 18, Oganesson (Og).[30]
Ædelgasserne har fyldte valenselektronskaller. Valenselektroner er de yderst placerede elektroner i et atom og er normalvis de eneste elektroner, der deltager i kemisk binding. Atomer med fyldte valenselektronskaller er ekstremt stabile og har derfor tendens til ikke at danne kemiske bindinger og har desuden lille tendens til at modtage eller afgive elektroner.[31] Tungere ædelgasser såsom radon holdes dog mindre fast sammen af den elektromagnetiske kraft end lettere ædelgasser såsom helium, hvilket gør det nemmere at fjerne ydre elektroner.
Som et resultat af en fyldt skal kan ædelgasserne bruges i forbindelse med elektronkonfigurationnotationen til at danne ædelgasnotationen. For at gøre dette skrives det kemiske symbol for den nærmeste ædelgas, der har et lavere atomnummer end det pågældende grundstof. Derefter følger elektronkonfigurationen af samtlige elektroner som ædelgassen ikke har. For eksempel er elektronnotationen af carbon 1s²2s²2p², og ædelgasnotationen er [He]2s²2p². Denne notation gør det lettere at identificere et grundstof og er kortere og lettere end at skrive den fulde notation af atomorbitalerne.[32]

Forbindelser
Ædelgasserne viser utrolig begrænset kemisk reaktivitet; som konsekvens heraf er kun nogle få hundrede ædelgasforbindelser blevet dannet. Neutrale forbindelser, i hvilke helium og neon er involverede i kemiske bindinger, er ikke blevet dannet, mens xenon, krypton og argon har vist lidet reaktivitet.[33]
I 1933 forudså Linus Pauling, at de tungere ædelgasser kunne danne forbindelser med fluor og oxygen. Han forudså eksistensen af kryptonhexafluorid (KrF6) og xenonhexafluorid (XeF6), overvejede at XeF8 kunne eksistere som en ustabil forbindelse og foreslog, at xenonsyre kunne danne perxenatsalte.[34][35] Disse forudsigelser viste sig generelt at være nøjagtige, undtagen XeF8, som nu betragtes som både termodynamisk og kinetisk ustabil.[36]
Xenonforbindelser forekommer i det højeste antal af de ædelgasforbindelser, der er blevet dannet.[37] De fleste af dem har xenonatomet på oxidationstrin +2, +4, +6 eller +8 bundet til meget elektronegative atomer såsom fluor eller oxygen, som i xenondifluorid (XeF2), xenontetrafluorid (XeF4), xenonhexafluorid (XeF6), xenontetroxid (XeO4) og natriumperxenat (Na4XeO6). Nogle af disse forbindelser har fundet anvendelse i kemisk syntese som oxidationsmidler; XeF2 er især kommercielt tilgængelig og kan bruges som et fluorineringsmiddel.[38] Pr. 2007 er omkring 500 forbindelser af xenon bundet til andre grundstoffer blevet identificeret, inklusiv organoxenonforbindelser (som er bundet til carbon) og xenon bundet til nitrogen, klor, guld, kviksølv og xenon selv.[33][39] Forbindelser af xenon bundet til bor, hydrogen, brom, iod, beryllium, svovl, titan, kobber og sølv er også blevet observeret, men kun ved lave temperaturer i ædelgasmatricer eller i supersoniske ædelgasjets.[33]
I teorien er radon mere reaktiv end xenon, og derfor skulle den lettere danne forbindelser end xenon. I praksis er der dog kun blevet dannet få fluorider og oxider af radon grundet den høje radioaktivitet af radonisotoperne.[40] Krypton derimod er mindre reaktiv end xenon, men mange forbindelser er blevet raporteret med krypton på oxidationstrin +2 bundet til fluor, men også bundet til nitrogen og oxygen (hvilke kun er stabile under henholdsvis -60 °C og -90 °C).[33] Kryptonatomer binder kemisk til andre ikke-metaller (brint, klor, kulstof), men også forbindelser med sene overgangsmetaller (kobber, sølv, guld) er blevet observeret – dog kun ved lave temperaturer i ædelgasmatricer eller i supersoniske ædelgasjets.[33] Lignende betingelser blev brugt til at udvinde de første få forbindelser, hvori argon indgik i 2000, såsom argonfluorhydrid (HArF) og nogle bundet til de sene overgangsmetaller kobber, sølv og guld.[33] Pr. 2007 kendes ingen stabile neutrale molekyler, der involverer kovalent bundet helium eller neon.[33]
Ædelgasserne – inklusiv helium – kan danne stabile molekylære ioner i gasfasen. Den mest simple er hydrohelium-ionen, HeH+, fundet i 1925.[41] Eftersom denne består af de to mest forekomne grundstoffer i universet, hydrogen og helium, anses den at forekomme naturligt i interstellart medium, selvom den dog endnu ikke er blevet påvist.[42] Foruden disse ioner er der mange kendte neutrale excimerer af ædelgasserne. Dette er forbindelser såsom ArF og KrF, der kun er stabile når de er i exciteret tilstand; nogle af dem anvendes i excimerlaserer.
Ædelgasser danner udover forbindelser, hvor de indgår med kovalente bindinger, også ikke-kovalente forbindelser. Heraf blev først klatraterne opdaget, hvor et ædelgasatom er fanget i et hulrum af krystalgitter af visse organiske og uorganiske substanser. Den essentielle betingelse for dannelsen af disse er, at det fremmede atom (ædelgassen) skal være af passende størrelse til at passe i hulrummet af værtens krystalgitter. For eksempel danner argon, krypton og xenon klatrater med vand og med hydroquinon, men helium og neon gør ikke, idet de er for små eller utilstrækkeligt polariserbare til at bibeholdes.[43]

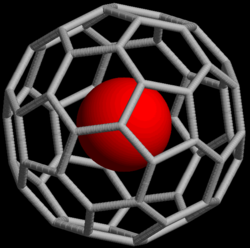
Ædelgasser kan danne endohedrale fullerenforbindelser, i hvilke ædelgasatomet er indespærret i et fullerenmolekyle. I 1993 blev det opdaget, at når C60, et sfærisk molekyle bestående af 60 carbonatomer, bliver udsat for ædelgasser ved højt tryk, kan komplekser såsom He@C60 dannes (@-notationen indikerer, at He er inden i C60 men ikke kovalent bundet til det).[44] Pr. 2008 er endohedrale komplekser med helium, neon, argon, krypton og xenon blevet udvundet.[45] Disse forbindelser er blevet brugt til undersøgelse af fullereners struktur og reaktivitet ved hjælp af NMR på ædelgasatomet.[46]
Ædelgasforbindelser såsom xenondifluorid (XeF2) betragtes som værende hypervalente, fordi de bryder oktetreglen. Binding i sådanne forbindelser kan forklares ved at bruge en 3-center-4-elektronbindingsmodel.[47][48] Denne model blev foreslået i 1951 og drejer sig om binding af tre kolineære atomer. For eksempel beskrives binding i XeF2 ved et sæt af tre molekylorbitaler (MOs) afledt af p-orbitaler for hvert atom. Binding er et resultat af kombinationen af en fyldt p-orbital fra Xe med en halvfyldt p-orbital fra hvert F-atom, hvilket resulterer i en fyldt bindende orbital, en fyldt ikke-bindende orbital og en tom antibindende orbital. Den højestbesatte molekylorbital kan lokaliseres på de to endeatomer. Dette repræsenterer en lokalisering af ladning, som gøres mulig af fluors høje elektronegativitet.[49]
 |
Forekomst og produktion
Universets rigdom på ædelgasser aftager med stigning i atomnummer. Helium er det mest almindelige grundstof i universet efter hydrogen med en masseandel på omkring 24%. Det meste af universets helium blev dannet under Big Bang-nukleosyntese, men mængden af helium er stadigt stigende grundet fusionen af hydrogen i stjerne-nukleosyntese.[50][51] Rigeligheden på Jorden følger andre tendenser; for eksempel er helium kun den tredje mest forekomne ædelgas i atmosfæren. Grunden til dette er, at der intet urhelium er i atmosfæren; grundet atomernes små masser kan helium ikke bibeholdes af tyngdekraften.[52] Helium på Jorden kommer fra alfahenfaldet af tungere grundstoffer såsom uran og thorium fundet i jordskorpen og har tilbøjelighed til at akkumulere i naturgasaflejringer.[52] Rigelighed af argon derimod bliver forøget som resultat af betahenfald af kalium-40 (også fundet i jordskorpen), hvilket danner argon-40, som er den mest forekomne argonisotop på jorden på trods af, at den er relativt sjælden i Solsystemet. Denne proces er basis i kalium-argon-dateringsmetoden.[53] Xenon er til stede i uventet lille mængde i atmosfæren, hvilket er blevet kaldet manglende xenonproblemet; en teori er, at det manglende xenon kan være indespærret i mineraler i jordskorpen.[54] Radon dannes i lithosfæren ved alfahenfald af radium. Det kan sive ind i bygninger gennem revner i fundamentet, og ophobes i områder uden tilstrækkelig ventilation. Grundet dets høje radioaktivitet og mobilitet udviser radon en betydningsfuld sundhedsrisiko; et estimat fortæller, at radon er indblandet i 21.000 dødsfald grundet lungekræft blot i USA.[55]
| Forekomst | Helium | Neon | Argon | Krypton | Xenon | Radon |
|---|---|---|---|---|---|---|
| Solsystemet (for hvert siliciumatom)[56] | 2343 | 2,148 | 0,1025 | 5,515 × 10−5 | 5,391 × 10−6 | – |
| Jordens atmosfære (volumenandel i ppm)[57] | 5,20 | 18,20 | 9.340,00 | 1,10 | 0,09 | (0,06 – 18) × 10−19[58] |
| Vulkansk sten (masseandel i ppm)[24] | 3 × 10−3 | 7 × 10−5 | 4 × 10−2 | – | – | 1,7 × 10−10 |
| Gas | 2004 pris (USD/m3)[59] |
|---|---|
| Helium (industrikvalitet) | 4,20–4,90 |
| Helium (laboratoriekvalitet) | 22,30–44,90 |
| Argon | 2,70–8,50 |
| Neon | 60–120 |
| Krypton | 400–500 |
| Xenon | 4000–5000 |
Neon, argon, krypton og xenon bliver udvundet fra luft ved brug af metoder for fortætning af gasser, til at omdanne grundstoffer til flydende stadie, og fraktioneret destillation, til at adskille forskellige komponenter i blandinger. Helium produceres typisk ved at separere det fra naturgas, og radon isoleres fra det radioaktive henfald af radiumforbindelser.[11] Den naturlige forekomst af ædelgasserne har indflydelse på deres priser, hvormed argon er den billigste og xenon den dyreste. Som et eksempel lister tabellen til højre priser fra 2004 i USA for laboratoriemængder af hver gas.
Anvendelser
Ædelgasser har meget lave koge- og smeltepunkter, hvilket gør dem nyttige som kryotekniske kølemidler.[60] Flydende helium, som koger ved 4,2 K, bliver især brugt som superledende magneter, såsom de der benyttes ved MR-scanning og NMR.[61] Flydende neon kan også anvendes i kryoteknik, selvom det ikke når ligeså lave temperaturer som flydende helium, fordi det har over fyrre gange større kølekapacitet end flydende helium og over tre gange mere end flydende hydrogen.[58]
Helium bruges som komponent i vejrtrækningsgas som erstatning for nitrogen grundet dets lave opløselighed i væsker, specielt i lipider. Gasser optages af blod og kropsvæv, når det udsættes for tryk som i SCUBA, hvilket skaber en anæstesisk effekt kendt som nitrogennarkose.[62] Grundet dets nedsatte opløselighed optages kun en smule helium i cellemembraner, og når helium anvendes til at erstatte dele af vejrtrækningsluften såsom i trimix og heliox, skabes en nedgang i den narkotiske effekt af gassen.[63] Heliums nedsatte opløselighed giver flere fordele ved tilstanden kendt som trykfaldssyge.[11][64] Den begrænsede mængde opløst gas i kroppen har den effekt, at færre gasbobler opstår under det mindskede tryk ved opstigningen. En anden ædelgas, argon, betragtes som den bedste mulighed til brug som oppustningsgas i tørdragt til scuba diving.[65]

Siden LZ 129 Hindenburg-katastrofen i 1937,[66] har helium erstattet hydrogen som bæregas i blimps og balloner grundet dets lethed og uforbrændelighed trods en 8,6%[67] nedgang i opdriften.[11]
I mange sammenhænge bruges ædelgasserne til at skabe en inert atmosfære. Argon bruges i syntesen af luftfølsomme forbindelser, som er følsomme over for nitrogen. Fast argon bruges til undersøgelser af meget ustabile forbindelser, såsom reaktive intermediater ved at indespærre dem i en inert matrix ved meget lave temperaturer.[68] Helium bruges som bæremedium i gaskromatografi som fyldgas i termometre og i anordninger til måling af stråling, såsom geigertælleren og boblekamre.[59] Helium og argon bruges begge normalt til at beskytte svejsebuer og de omgivende uædle metaller fra atmosfæren under svejsning og skæring, såvel som i andre metallurgiske processer samt i produktionen af silicium til halvlederindustrien.[58]
Ædelgasser bruges jævnligt til belysning på grund af deres mangel på kemisk reaktivitet. Argon blandet med nitrogen bruges som fyldgas i glødelamper[58] Krypton anvendes i high-performance-pærer, som har højere farvetemperaturer og større effektivitet på grund af, at det nedsætter fordampningsraten på filamentet mere end argon; for at tage et eksempel bruger halogenlamper krypton blandet med små mængder af forbindelser af iod eller brom.[58] Ædelgasser gløder i specifikke farver, når de bruges i gasudladningslamper, såsom neonlys, som producerer en orangerød farve. Xenon bruges normalt i xenon-buelamper, som grundet deres næsten kontinuerte spektrum der ligner dagslys, kan anvendes i filmprojektorer og som bilforlygter.[58]
Ædelgasserne anvendes i såkaldte excimerlasere, som virker ved hjælp af molekyler, kaldet excimerer, hvis elektroner kortvarigt kan exciteres. Hertil kan benyttes dimere af ædelgasserne, så som Ar2, Kr2 og Xe2, eller den mere udbredte kombination af en ædelgas og en halogen i excimerer som ArF, KrF, XeF, or XeCl. Disse lasdere giver et ultraviolet lys, som i kraft af sin korte bølgelængde (193 nm for ArF og 248 nm for KrF) kan afbilde objekter meget præcist. Excimerlasere har en lang række anvendelser indenfor industri, medicin og forskning: De bruges til mikrolitografi og fremstilling af mikroskopiske strukturer, af afgørende betydning for fremstillingen af integrerede kredsløb, og i laserkirurgi, herunder laser-angioplasti og øjenkirurgi.[69]
Visse ædelgasser finder direkte anvendelse indenfor lægegerningen: Helium bruges undertiden for at lette astma-patienters åndedræt.[58] Xenon bruges som et bedøvelsesmiddel på grund af dets høje opløselighed i fedtstoffer (det gør denne gas mere effektiv end den mere almindelige lattergas), og fordi det udskilles meget let fra kroppen[70] Xenon bruges desuden i forbindelse med afbildning af lungerne i såkaldt hyperpolariseret MRI.[71] Det stærkt radioaktive radon, der kun er tilgængeligt i små mængder, bruges til stråleterapi.[11]
- »Neon«-rør med forskellige ædelgasser lyser i forskellige farver
- (c) Pslawinski, CC BY-SA 2.5Helium
- (c) Pslawinski, CC BY-SA 2.5Neon
- (c) Pslawinski, CC BY-SA 2.5Argon (tilsat kviksølv)
- (c) Pslawinski, CC BY-SA 2.5Krypton
- (c) Pslawinski, CC BY-SA 2.5Xenon
Se også
- Ædelmetal, om metaller der er modstandsdygtige overfor korrosion eller iltning.
Noter
- ^ Renouf, Edward (15. februar 1901). "Noble gases". Science. 13: 268-270. doi:10.1126/science.13.320.268. ISSN 0036-8075.
- ^ Ozima 2002, s. 30
- ^ Ozima 2002, s. 4
- ^ "argon". Encyclopædia Britannica. 2008.
- ^ Oxford English Dictionary (1989), s.v. "helium". Hentet 16. december 2006, from Oxford English Dictionary Online. Also, from quotation there: Thomson, W. (1872). Rep. Brit. Assoc. xcix: "Frankland and Lockyer find the yellow prominences to give a very decided bright line not far from D, but hitherto not identified with any terrestrial flame. It seems to indicate a new substance, which they propose to call Helium."
- ^ a b Ozima 2002, s. 1
- ^ Mendeleev 1903, s. 497
- ^ Ernest Rutherford; Robert Bowie Owens (1899), "Thorium and Uranium Radiation", Trans. R. Soc. Can., vol. 2, s. 9-12
- ^ Ernst Dorn: Über die von radioaktiven Substanzen ausgesandte Emanation. I: Abhandlungen der Naturforschenden Gesellschaft zu Halle. Bind 23, 1901, s. 1-15 Skabelon:URN.
- ^ James L. Marshall, Virginia R. Marshall (2003), "Ernest Rutherford, The "True Discoverer" of Radon", Bull. Hist. Chem., vol. 28, s. 76-83
- ^ a b c d e f g h i j "Noble Gas". Encyclopædia Britannica. 2008.
- ^ Cederblom, J. E. (1904). "The Nobel Prize in Physics 1904 Presentation Speech".
- ^ a b Cederblom, J. E. (1904). "The Nobel Prize in Chemistry 1904 Presentation Speech".
- ^ Gillespie, R. J.; Robinson, E. A. (januar 2007). "Gilbert N. Lewis and the chemical bond: the electron pair and the octet rule from 1916 to the present day". J Comput Chem. 28 (1): 87-97. doi:10.1002/jcc.20545. PMID 17109437.
{{cite journal}}: CS1-vedligeholdelse: Flere navne: authors list (link) - ^ a b Bartlett, N. (1962). "Xenon hexafluoroplatinate Xe+[PtF6]–". Proceedings of the Chemical Society (6): 218. doi:10.1039/PS9620000197.
- ^ Fields, Paul R.; Stein, Lawrence; Zirin, Moshe H. (1962). "Radon Fluoride". Journal of the American Chemical Society. 84 (21): 4164-4165. doi:10.1021/ja00880a048.
{{cite journal}}: CS1-vedligeholdelse: Flere navne: authors list (link) - ^ Grosse, A. V.; Kirschenbaum, A. D.; Streng, A. G.; Streng, L. V. (1963). "Krypton Tetrafluoride: Preparation and Some Properties". Science. 139: 1047-1048. doi:10.1126/science.139.3559.1047. PMID 17812982.
{{cite journal}}: CS1-vedligeholdelse: Flere navne: authors list (link) - ^ Khriachtchev, Leonid; Pettersson, Mika; Runeberg, Nino; Lundell, Jan; Räsänen, Markku (24. august 2000). "A stable argon compound". Nature. 406 (406): 874-876. doi:10.1038/35022551.
{{cite journal}}: CS1-vedligeholdelse: Flere navne: authors list (link) - ^ Oganessian, Yu. Ts. (1999). "Synthesis of Superheavy Nuclei in the 48Ca + 244Pu Reaction". Physical Review Letters. American Physical Society. 83: 3154. doi:10.1103/PhysRevLett.83.3154.
- ^ Livermorium, flerovium join periodic table names Arkiveret 4. juni 2012 hos Wayback Machine 31. maj 2012 (engelsk)
- ^ "Gas Phase Chemistry of Superheavy Elements" (PDF). Texas A&M University. Arkiveret fra originalen (PDF) 28. maj 2008. Hentet 2008-05-31.
- ^ Wilson, Elaine (2005). "Making Meaning in Chemistry Lessons". Electronic Journal of Literacy through Science. 4 (2).
- ^ Oganessian, Yu. Ts. (9. oktober 2006). "Synthesis of the isotopes of elements 118 and 116 in the Skabelon:SimpleNuclide and Skabelon:SimpleNuclide + Skabelon:SimpleNuclide fusion reactions". Physical Review C. 74 (4): 44602. doi:10.1103/PhysRevC.74.044602.
- ^ a b c d Greenwood 1997, s. 891
- ^ Ved et tryk på 25 bar
- ^ "Solid Helium". University of Alberta. Arkiveret fra originalen 31. maj 2008. Hentet 2008-06-22.
- ^ Wheeler, John C. (1997). "Electron Affinities of the Alkaline Earth Metals and the Sign Convention for Electron Affinity". Journal of Chemical Education. 74: 123-127.;Kalcher, Josef; Sax, Alexander F. (1994). "Gas Phase Stabilities of Small Anions: Theory and Experiment in Cooperation". Chemical Reviews. 94: 2291-2318. doi:10.1021/cr00032a004.
{{cite journal}}: CS1-vedligeholdelse: Flere navne: authors list (link) - ^ Mott, N. F. (1955). "John Edward Lennard-Jones. 1894-1954". Biographical Memoirs of Fellows of the Royal Society. 1: 175-184. doi:10.1098/rsbm.1955.0013.
- ^ Ozima 2002, s. 2
- ^ "Scientists Announce Creation of Atomic Element, the Heaviest Yet". Washington Post. 2006-10-17. Hentet 2008-06-26.
- ^ Ozima 2002, s. 35
- ^ CliffsNotes 2007, s. 15
- ^ a b c d e f g Grochala, Wojciech (2007). "Atypical compounds of gases, which have been called noble". Chemical Society Reviews. 36 (36): 1632-1655. doi:10.1039/b702109g.
- ^ Pauling, Linus (juni 1933). "The Formulas of Antimonic Acid and the Antimonates". Journal of the American Chemical Society. 55 (5): 1895-1900. doi:10.1021/ja01332a016.
- ^ Holloway 1968
- ^ Seppelt, Konrad (juni 1979). "Recent developments in the Chemistry of Some Electronegative Elements". Accounts of Chemical Research. 12: 211-216. doi:10.1021/ar50138a004.
- ^ Moody, G. J. (oktober 1974). "A Decade of Xenon Chemistry". Journal of Chemical Education. 51 (10): 628-630. Hentet 2007-10-16.
- ^ Zupan, Marko; Iskra, Jernej; Stavber, Stojan (1998). "Fluorination with XeF2. 44. Effect of Geometry and Heteroatom on the Regioselectivity of Fluorine Introduction into an Aromatic Ring". J. Org. Chem. 63 (3): 878-880. doi:10.1021/jo971496e.
{{cite journal}}: CS1-vedligeholdelse: Flere navne: authors list (link) - ^ Harding 2002, s. 90–99
- ^ Avrorin, V. V.; Krasikova, R. N.; Nefedov, V. D.; Toropova, M. A. (1982). "The Chemistry of Radon". Russian Chemical Review. 51 (1): 12-20. doi:10.1070/RC1982v051n01ABEH002787.
{{cite journal}}: CS1-vedligeholdelse: Flere navne: authors list (link) - ^ Hogness, T. R.; Lunn, E. G. (1925). "The Ionization of Hydrogen by Electron Impact as Interpreted by Positive Ray Analysis". Physical Review. 26: 44-55. doi:10.1103/PhysRev.26.44.
{{cite journal}}: CS1-vedligeholdelse: Flere navne: authors list (link) - ^ Fernandez, J.; Martin, F. (2007). "Photoionization of the HeH2+ molecular ion". J. Phys. B: At. Mol. Opt. Phys. 40: 2471-2480. doi:10.1088/0953-4075/40/12/020.
{{cite journal}}: CS1-vedligeholdelse: Flere navne: authors list (link) - ^ Greenwood 1997, s. 893
- ^ Saunders, M.; Jiménez-Vázquez, H. A.; Cross, R. J.; Poreda, R. J. (1993). "Stable compounds of helium and neon. He@C60 and Ne@C60". Science. 259: 1428-1430. doi:10.1126/science.259.5100.1428. PMID 17801275.
{{cite journal}}: CS1-vedligeholdelse: Flere navne: authors list (link) - ^ Saunders, Martin; Jimenez-Vazquez, Hugo A.; Cross, R. James; Mroczkowski, Stanley; Gross, Michael L.; Giblin, Daryl E.; Poreda, Robert J. (1994). "Incorporation of helium, neon, argon, krypton, and xenon into fullerenes using high pressure". J. Am. Chem. Soc. 116 (5): 2193-2194. doi:10.1021/ja00084a089.
{{cite journal}}: CS1-vedligeholdelse: Flere navne: authors list (link) - ^ Frunzi, Michael; Cross, R. James; Saunders, Martin (2007). "Effect of Xenon on Fullerene Reactions". Journal of the American Chemical Society. 129: 13343. doi:10.1021/ja075568n.
- ^ Greenwood 1997, s. 897
- ^ Weinhold 2005, s. 275–306
- ^ Pimentel, G. C. (1951). "The Bonding of Trihalide and Bifluoride Ions by the Molecular Orbital Method". The Journal of Chemical Physics. 19 (4): 446-448. doi:10.1063/1.1748245.
- ^ Weiss, Achim. "Elements of the past: Big Bang Nucleosynthesis and observation". Max Planck Institute for Gravitational Physics. Arkiveret fra originalen 8. februar 2007. Hentet 2008-06-23.
- ^ Coc, A.; et al. (2004). "Updated Big Bang Nucleosynthesis confronted to WMAP observations and to the Abundance of Light Elements". Astrophysical Journal. 600: 544. doi:10.1086/380121.
{{cite journal}}: Eksplicit brug af et al. i:|author=(hjælp) - ^ a b Morrison, P.; Pine, J. (1955). "Radiogenic Origin of the Helium Isotopes in Rock". Annals of the New York Academy of Sciences. 62 (3): 71-92. doi:10.1111/j.1749-6632.1955.tb35366.x.
- ^ Scherer, Alexandra (2007-01-16). "40Ar/39Ar dating and errors". Technische Universität Bergakademie Freiberg. Hentet 2008-06-26.
- ^ Sanloup, Chrystèle; et al. (2005). "Retention of Xenon in Quartz and Earth's Missing Xenon". Science. 310 (5751): 1174-1177. doi:10.1126/science.1119070. PMID 16293758.
{{cite journal}}: Eksplicit brug af et al. i:|last2=(hjælp) - ^ "A Citizen's Guide to Radon". U.S. Environmental Protection Agency. 2007-11-26. Hentet 2008-06-26.
- ^ Lodders, Katharina (2003). "Solar System Abundances and Condensation Temperatures of the Elements". The Astrophysical Journal. 591: 1220-1247. doi:10.1086/375492.
- ^ "The Atmosphere". National Weather Service. Hentet 2008-06-01.
- ^ a b c d e f g Häussinger, Peter; Glatthaar, Reinhard; Rhode, Wilhelm; Kick, Helmut; Benkmann, Christian; Weber, Josef; Wunschel, Hans-Jörg; Stenke, Viktor; Leicht, Edith; Stenger, Hermann (2002). "Noble gases". Ullmann's Encyclopedia of Industrial Chemistry. Wiley. doi:10.1002/14356007.a17_485.
{{cite book}}: CS1-vedligeholdelse: Flere navne: authors list (link) - ^ a b Hwang, Shuen-Chen; Lein, Robert D.; Morgan, Daniel A. (2005). "Noble Gases". Kirk Othmer Encyclopedia of Chemical Technology. Wiley. s. 343-383. doi:10.1002/0471238961.0701190508230114.a01.
{{cite book}}: CS1-vedligeholdelse: Flere navne: authors list (link) - ^ "Neon". Encarta. 2008.
- ^ Zhang, C. J.; Zhou, X. T.; Yang, L. (januar 1992). "Demountable coaxial gas-cooled current leads for MRI superconducting magnets". Magnetics, IEEE Transactions on. IEEE. 28 (1): 957-959. doi:10.1109/20.120038.
{{cite journal}}: CS1-vedligeholdelse: Flere navne: authors list (link) - ^ Fowler, B; Ackles, K. N.; Porlier, G. (1985). "Effects of inert gas narcosis on behavior—a critical review". Undersea Biomed. Res. 12 (4): 369-402. ISSN 0093-5387. OCLC 2068005. PMID 4082343. Arkiveret fra originalen 25. december 2010. Hentet 2008-04-08.
- ^ Bennett 1998, s. 176
- ^ Vann, R. D. (ed) (1989). "The Physiological Basis of Decompression". 38th Undersea and Hyperbaric Medical Society Workshop. 75(Phys)6-1-89: 437. Arkiveret fra originalen 5. januar 2010. Hentet 2008-05-31.
{{cite journal}}:|first=har et generisk navn (hjælp) - ^ Maiken, Eric (2004-08-01). "Why Argon?". Decompression. Hentet 2008-06-26.
- ^ "Disaster Ascribed to Gas by Experts". The New York Times. 7. maj 1937. s. 1.
- ^ Freudenrich, Craig (2008). "How Blimps Work". HowStuffWorks. Hentet 2008-07-03.
- ^ Dunkin, I. R. (1980). "The matrix isolation technique and its application to organic chemistry". Chem. Soc. Rev. 9: 1-23. doi:10.1039/CS9800900001.
- ^ Basting, Dirk; Marowsky, Gerd (2005). Excimer Laser Technology. Springer. ISBN 3540200568.
{{cite book}}: CS1-vedligeholdelse: Flere navne: authors list (link) - ^ Sanders, Robert D.; Ma, Daqing; Maze, Mervyn (2005). "Xenon: elemental anaesthesia in clinical practice". British Medical Bulletin. 71 (1): 115-135. doi:10.1093/bmb/ldh034. PMID 15728132.
{{cite journal}}:|access-date=kræver at|url=også er angivet (hjælp)CS1-vedligeholdelse: Flere navne: authors list (link) - ^ Albert, M. S.; Balamore, D. (1998). "Development of hyperpolarized noble gas MRI". Nuclear Instruments and Methods in Physics Research A. 402: 441-453. doi:10.1016/S0168-9002(97)00888-7. Hentet 2007-10-01.
Referencer
- Bennett, Peter B.; Elliott, David H. (1998). The Physiology and Medicine of Diving. SPCK Publishing. ISBN 0702024104.
- Bobrow Test Preparation Services (5. december 2007). CliffsAP Chemistry. CliffsNotes. ISBN 047013500X.
- Greenwood, N. N.; Earnshaw, A. (1997). Chemistry of the Elements (2 udgave). Oxford:Butterworth-Heinemann. ISBN 0-7506-3365-4.
- Harding, Charlie J.; Janes, Rob (2002). Elements of the P Block. Royal Society of Chemistry. ISBN 0854046909.
- Holloway, John H. (1968). Noble-Gas Chemistry. London: Methuen Publishing. ISBN 0412211009.
{{cite book}}: CS1-vedligeholdelse: ref gentaget (link) - Mendeleev, D. (1902-1903). Osnovy Khimii (The Principles of Chemistry) (russisk) (7 udgave).
- Ozima, Minoru; Podosek, Frank A. (2002). Noble Gas Geochemistry. Cambridge University Press. ISBN 0521803667. (Webside ikke længere tilgængelig)
- Weinhold, F.; Landis, C. (2005). Valency and bonding. Cambridge University Press. ISBN 0521831288.
 | Wikimedia Commons har medier relateret til: |
Medier brugt på denne side
Forfatter/Opretter: Hajv01, Licens: CC BY-SA 4.0
Artistic rendering of a noble-gas atom caged within a buckminsterfullerene (C60) molecule. The structure was generated from actual molecular modeling data. The image was created with rasmol 2.7.2.1 (windows version). Only the endohedral atom has been represented by a sphere, while the carbon atoms of the cage and the corresponding carbon-carbon bonds are shown as cylinders.
(c) Pslawinski, CC BY-SA 2.5
Image of a krypton filled discharge tube shaped like the element’s atomic symbol.
Bonding in Xenon difluoride according to the 3-center-4-electron bond model.
Spectrum of helium (visible part)
Structure of Xenon tetraflouride, one of the first noble gas compounds to be discovered.
(c) KasugaHuang, CC BY-SA 3.0
Modern high field clinical MRI scanner. (3T Achieva, the product of Philips at Best, the Netherlands.)
(c) Pslawinski, CC BY-SA 2.5
Image of a helium filled discharge tube shaped like the element’s atomic symbol.
(c) Atlant, CC BY 2.5
Close-up of a 15KW Xenon short-arc lamp. See also end view.
(c) Pslawinski, CC BY-SA 2.5
Image of a xenon filled discharge tube shaped like the element’s atomic symbol.
(c) Pslawinski, CC BY-SA 2.5
Image of an argon filled discharge tube shaped like the element’s atomic symbol.
Forfatter/Opretter: Pumbaa (original work by Greg Robson), Licens: CC BY-SA 2.0 uk
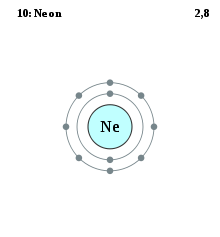
Electron shell diagram for Neon, the 10th element in the periodic table of elements.
Ionization energies of neutral elements, in units of eV.
Xenon difluoride resonance structures
(c) Pslawinski, CC BY-SA 2.5
Image of a neon filled discharge tube shaped like the element’s atomic symbol "Ne". Example of neon lighting. The letter "N" is about 75 cm tall.