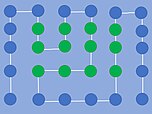
HP-model
En HP-model er den simpleste model, der kan beskrive proteinfoldning. Et protein er en fleksibel polymer bestående af flere aminosyrerester, der interagerer med hinanden og med omgivelserne for derved at give proteinet en bestemt udformning kaldet en foldning. Der findes 20 forskellige slags aminosyrer, men i HP-modellen forsimples disse til blot to typer aminosyrer - hydrofobe (H) og polære (P). Systemet simplificeres yderligere ved, at proteinet kun kan eksistere på et diskret gitter - et gitterprotein. I en vandig opløsning vil den mest fordelagtige proteinfoldning da være den, hvor færrest mulige H-aminosyrer er i kontakt med solventet og P-aminosyrerne.[1]
Modellen blev formuleret i 1985 af Ken Dill.[2]
Kildehenvisninger
- ^ a b Phillips, Rob; Kondev, Jane; Theriot, Julie; Garcia, Hernan G. (2003). "8.4 - Proteins as Random Walks". Physical Biology of the Cell (engelsk) (2. udgave). Garland Science. p. 344-351. ISBN 978-0-8153-4450-6.
- ^ Dill K.A. (1985). "Theory for the folding and stability of globular proteins". Biochemistry. 24 (6): 1501-9. doi:10.1021/bi00327a032. PMID 3986190.
| Spire Denne artikel om fysik er en spire som bør udbygges. Du er velkommen til at hjælpe Wikipedia ved at udvide den. |
Medier brugt på denne side
Nuclear physics
Forfatter/Opretter: Emandems1, Licens: CC BY-SA 4.0
A thermodynamically unstable conformation of a generic polypeptide. Hydrophobic residues are in green while polar residues are in blue.
Forfatter/Opretter: Emandems1, Licens: CC BY-SA 4.0
A thermodynamically stable conformation of a generic polypeptide. Hydrophobic residues are in green while polar residues are in blue.