Guld
 For alternative betydninger, se Aurum (flertydig).
For alternative betydninger, se Aurum (flertydig).
Guld (på latin aurum) er grundstof nummer 79 i det periodiske system og har det kemiske symbol Au. Under normale tryk- og temperaturforhold optræder dette overgangs- og ædelmetal som et meget tungt, yderst formbart gult metal.
Egenskaber
Guld reagerer ikke med langt de fleste kemikalier, men angribes dog af klor, fluor, kongevand og cyanid. Salpetersyre, som ellers kan opløse andre metaller, benyttes til at bekræfte, om et materiale indeholder guld. Kviksølv kan opløse guld, men stofferne danner ikke kemiske forbindelser med hinanden.

Guld er i sin rene form det mest formbare og duktile materiale, der kendes. Et enkelt gram af metallet kan hamres ud til en kvadratmeter bladguld. Det kan gøres tyndt nok til at blive gennemsigtigt. Lys, der passerer, får et blåt eller grønt skær, da guldet tilbagekaster de 'modsatte' farver: Rød og gul.
Det rene guld er således for blødt til de fleste praktiske formål og bruges derfor i legeringer med andre metaller som fx sølv og kobber. Når guld benyttes til smykker, angives dets renhed i karat. Rent guld er 24 karat, men til smykker benyttes ofte 22k, 18k eller 14k. Jo lavere "k" (karat), des højere er indholdet af sølv eller kobber i legeringen. Valget af metaller kan bruges til at justere farven på den resulterende legering. En større mængde af sølv, palladium eller nikkel giver hvidguld, mens en større mængde kobber giver rødguld.
Metallers farve skyldes atomernes evne til at absorbere og 'genudsende' energien i de fotoner ('lyspartikler'), der træffer det: Det er elektronerne i atomerne, der er ansvarlige for dette, og for de fleste metallers vedkommende gør dette nogenlunde lige meget for alle bølgelængder, hvilket giver en omtrent grå nuance. For gulds (og kobbers) vedkommende påvirkes 'elektron-havet' i metallet imidlertid af kvantemekaniske effekter, som giver markante forskelle i, hvor meget lys metallet kan 'genudsende' af de forskellige bølgelængder. Derfor har disse metaller en usædvanlig tydelig farve.
Det er muligt at størstedelen af alt guld i universet, og dermed på Jorden, er dannet ved de kosmiske begivenheder, der kaldes gammaglimt.[1][2]
Tekniske anvendelser
Guld har gennem århundreder været brugt som betalingsmiddel og til smykker, og i nyere tid også til en lang række tekniske formål.
Guld som betalingsmiddel
Indtil starten af 1900-tallet var udstedte mønters pålydende værdi generelt betinget af den pågældende mønts metalværdi. En mønt, hvis metalværdi modsvarer dens pålydende værdi, kaldes en hovedmønt, mens en mønt med en metalværdi lavere end den pålydende værdi benævnes en skillemønt. I slutningen af 1800-tallet gik Danmark og andre stater over til guldstandarden, det vil sige, at de større cirkulationsmønter var baseret på guld, samt at værdien af en nationalbanks udsendte pengesedler modsvaredes af en tilsvarende beholdning af fysisk guld i banken. Guld kom derved til direkte at garantere for værdien af staternes møntfod. Den rolle havde sølv tidligere været tildelt. Nogle få lande arbejdede ikke med en ren guld- eller sølvstandard, men med en blanding af de to, en såkaldt bimetal-standard. Systemet med guld-understøttelse af den udstedte valuta blev for de fleste staters vedkommende suspenderet i forbindelse med udbruddet af 1. verdenskrig. Senere forsøg på at genindføre guldstandarden blev generelt opgivet i slutningen af 1920'erne på grund af den daværende økonomiske krise. For Danmarks vedkommende var den danske krones værdi på daværende tidspunkt faldet i forhold til det britiske pund, der stadig var bundet til guldet. En genindførsel af "guldkronen" (i konservativ presse omtalt som "den ærlige krone") ville derfor medføre en revaluering med tab af konkurrenceevne til følge. Regeringen Madsen-Mygdal genindførte guldstandarden på trods af modstand fra Socialdemokratiet, der frygtede et tab af arbejdspladser som følge af revalueringen. Denne gang optrådte guldstandarden i form af en guldbarrestandard, hvilket vil sige, at guldmønter ikke indgik i det egentlige pengeomløb, men at Nationalbanken påtog sig at omveksle større pengebeløb til guldbarrer. Da en standard-guldbarre vejer 12,5 kilo, var adgangen til guldindløselighed reelt forbeholdt indehavere af meget store pengebeløb. Danmark afskaffede definitivt guldstandarden, efter at Storbritannien, Danmarks største samhandelspartner, selv afskaffede guldstandarden i 1931. Der findes ikke længere stater, hvis pengeudstedelse er 100 % understøttet af guld. Under guldstandarden udstedtes egentlige cirkulationsmønter normalt i legeringer af maksimalt 22 karats (91,67 %) finhed. De danske 10- og 20-krone mønter i guld havde en finhed på 900/1000.[3] På grund af den i samtiden høje værdi blev de dog kun brugt i mindre omfang. I Danmark benyttedes til daglig handel først og fremmest mønter i bronze eller sølv.
Visse lande udsteder stadig guldmønter: De såkaldte Canadian Gold Maple Leafs, Australian Gold Nuggets og østrigske Wiener Philharmonikere er de reneste af denne type mønter, med 99,99 % guld. Den kinesiske panda har finheden 99,90 %. Sydafrika, USA og Storbritannien udgiver henholdsvis Krugerrands, American Gold Eagles og britiske Gold Sovereigns og Gold Britannias, i alle tilfælde med en lødighed af 22 karat. Den lavere lødighed skyldes tradition samt et ønske om at lave et stærkere produkt, idet guld er meget blødt i ren tilstand. Ingen af disse mønter er beregnet til dagligt brug, hvilket ses af deres generelt meget lave pålydende værdier sammenholdt med mønternes faktiske metalværdi. Krugerrand er den eneste af disse investeringsmønter, som ikke har en pålydende.[kilde mangler] I stedet fungerer de først og fremmest som anbringelsesmetode for større værdier blandt personer, der ikke har tillid til deres lokale pengevæsen. Denne skik er først og fremmest udbredt i Asien og Mellemøsten. Mange lande i disse områder har love, der forbyder privatpersoner at eje guld med undtagelse af mønter og smykker. Udstedelsen af mønter af rent guld kan omgå sådanne forbud. Et tilsvarende forbud fandtes tidligere også i Danmark. Den første stat, der udstedte denne type mønter, var Sydafrika med udstedelsen af den såkaldte krugerrand, der indeholder 31,1 gram finguld.. Dette svarer til 1 troy ounce (oz t), hvilket er den enhed, som ædelmetaller noteres i på London Stock Exchange og New York Stock Exchange. Udstedelsen af krugerrands sikrede Sydafrika en eksportindtægt på et tidspunkt, hvor landet var underlagt international handelsblokade på grund af apartheidstyret, idet veksling af valuta ikke var omfattet af handelsblokaden. Som kuriosum kan bemærkes, at Letland i 1998 udstedte en 100 lats guldmønt i 16,2 gram finguld,[4] som officielt blev anset som almindeligt betalingsmiddel.[5]
Guldet i guldbarrer er til gengæld ofte 24 karat, fordi de modsat mønter ikke behøver være hårde eller slidstærke. Deres brug som investerings- og betalingsinstrument understreges af, at finguld er tildelt en tre-bogstavs-forkortelse på linje med alverdens valutaer; XAU.
Smykker af guld
Smykker af guld indeholder næsten altid andre metaller, primært for at gøre metallet modstandsdygtigt over for slitage. Smykker har gerne karat-tal mellem 8 og 22. Det 'andet' metal er oftest kobber, som giver legeringen lidt af dets karakteristiske rødlige farve. I 14 karat guld, hvor 'resten' af metallet er kobber, minder farven til forveksling om visse bronzelegeringer.
Ved at bruge jern og aluminium kan man skabe henholdsvis blå og violette guld-legeringer, men det bruges meget sjældent i smykke-sammenhænge. Palladium og nikkel giver en sølvhvid legering. Blanding med sølv giver en grøn-gul farve. Nikkel er langt det billigste, men da det er giftigt, er der lovgrænser for, hvor meget nikkel sådanne smykker må afgive.
Ud over metallet til selve smykket indgår guld også i det loddemetal, der bruges i fremstillingen af smykket: I et kvalitetsprodukt bør loddemetallet være af en karat, der svarer til karaten af smykkets øvrige bestanddele. Loddemetal af den art fremstilles med en lang række karat-tal og i forskellige farver, der matcher de føromtalte legeringer. Dertil laves loddemetallet med op til tre forskellige smeltepunkter. Ved at bruge varianterne med det højeste smeltepunkt først kan en guldsmed opbygge ganske komplicerede arbejder med talrige lodninger.
Medicinske anvendelser
I middelalderen troede man, at guld var gavnligt for helbredet, da noget så sjældent og smukt som guld nødvendigvis måtte være gavnligt. Selv i dag tilskriver visse alternative behandlere metallisk guld helbredende egenskaber.
Visse guld-holdige salte virker ganske vist infektionsbekæmpende og bruges i behandlingen af gigt og lignende lidelser, men det er vel at mærke kun salte og radioaktive isotoper af guld, der finder anvendelse i den moderne lægevidenskab. Som eksempel på det sidste kan nævnes isotopen 198Au med en halveringstid på 2,7 døgn, som bruges i strålebehandling mod visse former for kræft.
Til gengæld bruges guld af tandlæger, da det nemt formbare guld kan tilpasses i broer og kroner, der matcher de tilbageværende tænder, og generelt giver bedre resultater end andre materialer. Brug af guldkroner for de mest synlige tænder betragtes som attraktivt i visse kulturkredse og uattraktivt i andre.
Farvestof og overfladebehandling
Guld bruges som farvestof i glas, som derved får en intens, dybrød farve. Andre guld-baserede farvestoffer bruges til fotografier, hvor det kan gøre sort/hvide fotos lavet med sølvbromid let brunlige eller blålige, eller forbedre stabiliteten.
Guld kan også bruges som farvestof i mad. Dets e-nummer er E-175.
Guld, eller legeringer af guld og palladium, bruges til at overfladebehandle biologiske prøver og andre elektrisk isolerende emner, der skal undersøges med scanning-elektronmikroskop. Guld er ideelt til dette formål af tre grunde:
- Guldets gode lede-egenskaber bortleder den statiske elektricitet, der 'opsamles' på emnet under på grund af mikroskopets elektronstråle.
- Guld er godt til at standse de elektroner, der træffer det på overfladen af emnet: Trænger de for langt ind, bliver billedet af det sløret.
- Guld afgiver mange sekundære elektroner, som scanning-elektronmikroskopet bruger til at danne et billede.
Da guld reflekterer det meste af både synligt og infrarødt lys, bruges det ofte i rumfarten til at beskytte mod den intense solstråling uden for Jordens atmosfære: Som gyldne folier på satellitter og rumfartøjer og i et ganske tyndt lag i visiret på astronauternes rumdragter. Tilsvarende bruges guldfolie i visse Formel 1-racerbiler som varmeafskærmning i motorrummet. I compact discs af høj kvalitet ses guld undertiden brugt som det reflekterende lag i skiven.
Elektronik
Guld er en udmærket leder af elektrisk strøm, hvilket er blevet udnyttet til ledninger til meget stærke strømme. Både sølv og kobber er bedre til at lede strømmen, målt rumfang for rumfang, men guld er mere korrosionsbestandigt.
Den gode ledningsevne udnyttes i forskellige slags elektriske stik af høj kvalitet, hvis 'ben' og andre kontaktflader overtrækkes med guld. Der hersker en del debat om, hvorvidt guldet giver bedre lyd, billeder og dataforbindelser, men sådanne stikforbindelser må alt andet lige være mere korrosionsbestandige. Af samme grund bruges guld på overfladen af de elektriske dele i visse typer elektriske kontakter.
Gyldne fødevarer
Bladguld samt guld i flager og som pulver bruges i visse madvarer, særligt i slik. I E-nummer-systemet for tilsætningsstoffer i mad klassificeres guld som et farvestof med nummer E-175. Guld i flager blev brugt i middelalderen af den europæiske adel, dels for at demonstrere værtens velstand, dels ud fra føromtalte formodning om, at det er gavnligt for helbredet.
Da guld kemisk set er meget lidt reaktionsvilligt, indgår heller ikke i madens og vores fordøjelses kemi. Af samme grund smager det heller ikke af noget. Guld har ingen næringsmæssig værdi og forlader fordøjelseskanalen i uforandret kemisk form.
Symbolik
Guld er et ædelmetal, der sættes i forbindelse med Solen, men også som symbol på overjordisk storhed eller rigdom og velstand. Guld symboliserer evigheden, erkendelse og troskab. Alkymister betragtede guld som noget ædelt, i stræben efter lutring, esoterisk erkendelse og det højeste trin i åndelig udvikling. I Kina betragtedes guld som Solens metal og uressensen yang. Astrologisk hører guld til stjernetegnet løven.
I kristendommen er guld symbol på himmellyset og fuldkommenheden. I drømme kan guld betyde ny erkendelse og bevidsthedsudvidelse. Symboliserer maskuline værdier, i kvinders drømme animus. I auraen tydes guld som besiddelse af stor, gammel østerlandsk visdom.
Vinderen af konkurrencer ved de Olympiske Lege og andre mesterskaber får guldmedaljer. Guldmedaljerne til OL er dog lavet af 92,5 % sølv.[6]
Guldbryllup afholdes efter 50 års ægteskab.
Forekomst og udvinding

Udvinding af guld er økonomisk rentabelt, hvis råmaterialet indeholder blot et halvt gram guld pr. ton. Malm, der brydes i åbne miner, indeholder mellem 1 og 5 gram guld pr. ton. Fra underjordiske miner brydes malm med et guldindhold på omkring 3 gram pr. ton. Først ved et indhold på 30 gram pr. ton er guldet synligt for det blotte øje. Derfor ligner malm, der brydes i de fleste guldminer, almindeligt klippemateriale.
Produktion på landjorden
Omkring halvdelen af alt guld i verden stammer fra Sydafrika, hvor man har udvundet det siden 1880'erne. Anslået 145.000 tons ved udgangen af 2001. I 1970 stod Sydafrika bag 79 % af verdensproduktionen med omkring 1.000 tons. I 2007 var landets produktion faldet til blot 272 tons, primært på grund af stigende tekniske vanskeligheder ved udvindingen, skiftende økonomiske forhold og stramninger i sikkerhedsreglerne for minedrift. Netop dét år overhalede Kina Sydafrika med en produktion på 276 tons. Det var første gang siden 1905, at Sydafrika måtte se sig overgået på dette felt.
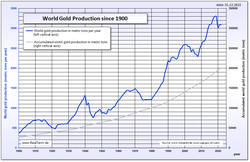
Andre væsentlige guldproducenter er USA, Australien, Rusland og Peru. I Sydamerika arbejdes der med et kontroversielt projekt, Pascua Lama, som handler om at udnytte de rige guldfelter i bjergene i Atacamaørkenen nær grænsen mellem Chile og Argentina.
Behandlingen af råmaterialet fra minerne sker enten ved Wohlwill-processen eller Miller-processen. Der findes dog også andre metoder.
En gigantisk kviksølvforurening truer flere områder i verden som følge af udvinding af guld ved hjælp af kviksølv. Det gælder filippinske guldgravere, der udleder mellem 200 og 500 ton kviksølv i naturen årligt ved småskala-minedrift.[7]
Guld fra havvand
Verdenshavene indeholder betydelige mængder guld, men fordelt jævnt i alt havvandet bliver koncentrationen uhyre lav; mellem 0,1 og 0,2 milligram pr. ton vand. En række mennesker har hævdet at have fundet en rentabel måde at udvinde dette guld, men det har i alle tilfælde været fejltagelser eller direkte svindel.
Fritz Haber forsøgte at udvikle en kommerciel metode til at udvinde havets guld i et forsøg på at finansiere de krigsskadeerstatninger, Tyskland var blevet pålagt efter 1. verdenskrig. Desværre havde han overvurderet guldkoncentrationen i havet, og den tyske regering endte med at bruge flere penge, end hvad salg af de små mængder udvundet guld kunne indbringe.

Bemærk målestokken
Alkymisternes gamle drøm om at omdanne mindre ædle materialer til guld er kommet inden for teknisk rækkevidde i moderne tid, men processen er langt fra rentabel og forventes ikke at blive det inden for en overskuelig fremtid.
Historie
Mennesket har kendt til guld og brugt det til udsmykning og ritualer siden forhistorisk tid; det kan have været det første metal, mennesket har brugt. I egyptiske hieroglyffer beskriver kong Tushratta omkring 2600 f.Kr., hvordan guld på den tid var "mere rigeligt end skidt". Egypten og Nubien havde naturresourcer, der gjorde dem til væsentlige guldproducenter gennem det meste af historien.
Guld nævnes ofte i Bibelens Gamle Testamente, første gang allerede i Skabelsesberetningen. Det sydøstlige hjørne af Sortehavet var kendt for sine guldforekomster, hvis udvinding siges at gå tilbage til kong Midas tid. Her fremstillede man mønter for første gang i historien mellem 643 og 640 f.Kr.

Mali-riget i Vestafrika var berømmet i den gamle Verden for sine enorme mængder guld. Rigets hersker, Mansa Musa blev berømt for sin pilgrimsrejse til Mekka i 1324: Da han nåede Cairo i juli med nærved 100 kameler og et følge på tusindvis af mennesker, gav han så meget guld bort, at det tog mere end et årti for landene i Nordafrika at komme sig over den kraftige inflation, det medførte.
Den europæiske udforskning af Amerika var i høj grad drevet af meldinger om rigelige og overdådige guldsmykker båret af de indfødte i Centralamerika, Peru og Colombia.
Op igennem det 1800-tallet udløstes flere gange 'guldfeber', når nye store guldforekomster blev opdaget. Det første væsentlige tilfælde af guldfeber i USA opstod i en lille by kaldet Dahlonega. Andre tilfælde indtraf i Californien, Colorado, Otago, Australien og Witwatersrand. Det mest berømte tilfælde var Klondike.
Isotoper af guld
Naturligt forekommende guld består af én enkelt isotop; 197Au. Dertil kendes 36 radioaktive isotoper, hvoraf 195Au er den mest 'langlivede', med en halveringstid på godt 186 døgn.
Se også
Noter
- ^ "Forskere har fundet guldets kilde. Videnskab.dk". Arkiveret fra originalen 26. juli 2013. Hentet 4. august 2013.
- ^ Gammaglimt afslører kosmisk kæmpekollision. Videnskab.dk
- ^ "Guldpriser". Arkiveret fra originalen 14. februar 2008. Hentet 5. marts 2008.
- ^ "100 lats (Ls 100 in short) | Bank of Latvia". Arkiveret fra originalen 20. februar 2008. Hentet 3. marts 2008.
- ^ 1996_98 | Bank of Latvia (Webside ikke længere tilgængelig)
- ^ Olympic Facts & Figures- United States Olympic Committee
- ^ Gigantisk kviksølvkatastrofe truer Filippinerne. Videnskab.dk 2010
Eksterne henvisninger
| Søsterprojekter med yderligere information: |
Medier brugt på denne side
Forfatter/Opretter: Eckhard Pecher, Licens: CC BY 2.5
Gold Processing at a workshop in Kanazawa, Japan
Forfatter/Opretter: Kowloonese (diskussion · bidrag), Licens: CC BY-SA 3.0
Gold nugget in National Museum of Natural History. Nugget is about 6 inches (15 cm) long.
Forfatter/Opretter: Jon Bodsworth, Licens: Copyrighted free use
Golden funeral mask of king Tutankhamun
World gold production (in metric tons per year), in addition accumulated world gold production
Forfatter/Opretter: Alchemist-hp (talk) www.pse-mendelejew.de, Licens: CC BY-SA 3.0 de
Synthetic made gold crystals by the chemical transport reaction in chlorine gas. Purity >99.99%
(c) Peo at the Danish language Wikipedia, CC BY-SA 3.0
Denne tegning forestiller elektronkonfigurationen i et guldatom: Den store kugle i midten forestiller atomkernen, og de små kugler er elektronerne. Bogstaverne på elektron-kuglerne angiver hvilken orbital de tilhører. Den lyserøde farve markerer at guld hører til overgangsmetallerne.







