Fosforsyre
| Fosforsyre | |
|---|---|
 | |
| Generelt | |
| Systematisk navn | trihydroxidooxidofosfor |
| Andre navne | Forsforsyre |
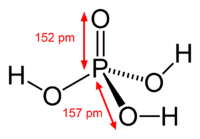
| Molekylformel | H3PO4 |
| Molmasse | 97,995 g/mol |
| Fremtræden | Hvidt fast stof eller farveløs tyktflydende væske (>42 °C) |
| CAS nummer | [7664-38-2] |
| Egenskaber | |
| Massefylde | 1,885 g/mL (væske) 1,685 g/mL (85% opløsning) 2,030 g/mL (krystal ved 25 °C) |
| Opløselighed | 14,0 g/L |
| Smeltepunkt | 42,35 °C (vandfrit) 29,32 °C (hemihydrat) |
| Kogepunkt | > 158 °C (dekomponere) |
| Syrestyrkekonstant (pKa) | 2,148, 7,198, 12,319 |
| Viskositet | 2,4–9,4 cP (85% aq. opl.) 147 cP (100%) |
| Struktur | |
| Termokemi | |
| Standard molar entropi S | 158 J·mol^−1·K^−1 |
| Farmakologi | |
| Explosive data | |
| Sikkerhed | |
| Side med supplerende data | |
| Struktur og egenskaber | n, εr, etc. |
| Thermodynamiske egenskaber | Faseopførsel Fast stof, væske, gas |
| Spektrale data | UV, IR, NMR, MS |
| Beslægtede Stoffer | |
| Hvis ikke andet er angivet, er data givet for stoffer i standardtilstanden (ved 25 °C, 100 kPa) | |
Fosforsyre er (eller phosphorsyre) en middelstærk, trivalent syre med formlen H3PO4. Fosforsyre bruges bl.a. som tilsætning til madvarer og har i den forbindelse E-nummeret E338.
Anvendelser
- Fjernelse af rust.
- Fjernelse af kalkaflejringer fra automatiske vandingssystemer.
- Ingrediens i læskedrik, fx cola.
- Bruges også til at danne salte til gødning da planter ellers ikke vil optage fosfor.
Fosforsyre, orthofosforsyre, H3PO4 eller (HO)3PO, farveløst krystallinsk stof, smeltepunkt 42,3 °C.
Fosforsyre er en middelstærk trivalent syre, der ætser mindre end svovlsyre, og som først ved højere temperaturer virker oxiderende. Den anvendes især til fremstilling af kunstgødninger og i mindre omfang til passivering af jern, idet den kan danne et beskyttende lag af jern- fosfat på jernoverflader.
Kemiske reaktioner
Ved en normal syre-base reaktion afgiver fosforsyre en H+ ion og bliver til H2PO4-, som er en amfolyt. Fosforsyre er desuden en triprotsyre. Dette vil sige at den kan afgive 3 hydroner. Afgivelsen af hydroner sker trinvist, i takt med forøgning af pH.
Fosfat i biokemien
Forforsyre indgår som fosfat i mange vigtige biokemiske molekyler, nukleinsyrerne DNA og RNA, mange proteiner, cofaktorer og energistoffet ATP foruden i toxiner og andre giftstoffer. Vedhæftning af fosfat til et organisk molekyle betegnes som fosforylering.
| Spire Denne artikel om kemi er en spire som bør udbygges. Du er velkommen til at hjælpe Wikipedia ved at udvide den. |
|
Medier brugt på denne side
Chemistry, Chemical Template

