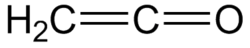Ethenon
| Ethenon | |
|---|---|
 | |
| Generelt | |
| Andre navne | Keten Carbomethen Ketoethylen |
| Molekylformel | C2H2O |
| Molarmasse | 42,037 g/mol |
| Fremtræden | Farveløs gas |
| CAS-nummer | |
| EC-nummer | 207-336-9 |
| PubChem | |
| SMILES | O=C=C |
| InChI | 1/C2H2O/c1-2-3/h1H2 |
| Kemiske egenskaber | |
| Massefylde | 1,93 g/cm3 |
| Opløselighed i vand | Dekomponerer |
| Opløselighed | Opløselig i acetone, ætanol, diethylether, aromatiske opløsningsmidler og alkylhalider |
| Smeltepunkt | -151 °C (122,15 K)[1] |
| Kogepunkt | -49,8 °C (223,35 K)[1] |
| Refraktionsindeks | 1,4355 |
| Struktur | |
| Termokemi | |
| DeltaHf | -47,5 kJ mol-1[1] |
| Std. molar entropi S | 247,6 J K-1 mol-1[1] |
| Std. molar varmekapacitet, cp | 51,8 J K-1 mol-1[1] |
| Sikkerhed | |
| NFPA 704 | |
| Explosionsgrænser | 5,5-18 % |
| LD50 | 1300 mg/kg (oralt, rotte) |
| Hvis ikke andet er angivet, er data givet for stoffer i standardtilstanden (ved 25 °C, 100 kPa) | |
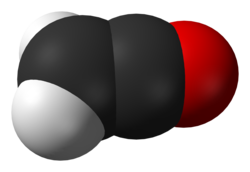
Ethenon er det systematiske navn for keten, en organisk forbindelse med den kemiske formel C2H2O eller H2C=C=O. Det er det simpleste medlem af klassen af ketener. Det er en tautomer af ethynol.
Egenskaber
Ethenon er en yderst giftig farveløs gas ved standardbetingelser og har en skarp, ubehagelig lugt. Det er opløseligt i acetone, ætanol, diethylether, aromatiske opløsningsmidler og alkylhalider.
Fremstilling
Ethenon kan fremstilles i laboratoriet ved pyrolyse af acetonedampe.[2] Det kan tillige dannes ved at reagere acetylklorid med en protonacceptor som f.eks. trimethylamin.
Reaktioner
Ethenon er meget reaktivt og undergår let reaktion med nukleofiler under dannelse af en acetylgruppe. Det reagerer f.eks. med vand under dannelse af eddikesyre;[3] med eddikesyre under dannelse af eddikesyreanhydrid; med ammoniak (NH3) og aminer under dannelse af ethanamider;[4] og med tørre hydrogenhalider under dannelse af acetylhalider.
Ethenon kan desuden reagere med sig selv via en [2+2]-cykloadditionsreaktion under dannelse af cykliske dimerer kaldt diketener. Af denne grund bør ethenon ikke opbevares i længere tid.[5]
Risici
Hvis et menneske udsættes for koncentrerede niveauer af ethenon, kan det forårsage irritation af kropsdele som f.eks. øjne, næse, svælg og lunger. Omfattende studier af ethenons giftighed foretaget på mus, rotter, marsvin og kaniner viste, at udsættelse for nyfremstillet ethenon i 10 minutter ved koncentrationer ned til 0,2 mg/liter (116 ppm) medførte en høj procentdel af dødsfald hos små dyr. Disse studier anbragte ethenon i samme giftighedskategori som fosgen (0,2–20 mg/liter) og blåsyre (hydrogencyanid, 0,2-0,5 mg/liter). Døden indtræffer som følge af lungeødem, ligesom det er tilfældet med fosgenforgiftning, om end ethenon virker langt hurtigere.[6]
Grænseværdien for erhvervsmæssig eksponering er sat til 0,5 ppm (0,9 mg/m3) i gennemsnit over en otte-timers-periode.[7] IDLH-grænseværdien er sat til 5 ppm, da dette er den laveste koncentration, der kan fremkalde et klinisk relevant fysiologisk respons hos mennesker.[8]
Referencer
- ^ a b c d e Andersen, Erik Strandgaard; Jespergaard, Paul; Østergaard, Ove Grønbæk. DATABOG fysik kemi, 11. udgave, pp. 116-117. København: F & K forlaget, 2009. ISBN 978-87-87229-61-6.
- ^ Hurd, CD. "Ketene". Org. Synth. 1925 (4): 39. doi:10.15227/orgsyn.004.0039. (engelsk)
- ^ Tidwell, p. 11 Arkiveret 2. februar 2017 hos Wayback Machine.
- ^ Tidwell, p. 560.
- ^ Christoph Taeschler :Ketenes, Ketene Dimers, and Related Substances, Kirk-Othmer Encyclopedia of Chemical Technology, John Wiley & Sons, New York, 2010 (engelsk)
- ^ H. A. Wooster; C. C. Lushbaugh; C. E. Redeman (1946). "The Inhalation Toxicity of Ketene and of Ketene Dimer". J. Am. Chem. Soc. 68 (12): 2743. doi:10.1021/ja01216a526. (engelsk)
- ^ Centers for Disease Control and Prevention (4. april 2013). "Ketene". NIOSH Pocket Guide to Chemical Hazards. Arkiveret fra originalen 20. december 2016. Hentet 29. januar 2017. (engelsk)
- ^ Centers for Disease Control and Prevention (maj 1994). "Ketene". Documentation for Immediately Dangerous To Life or Health Concentrations (IDLHs). Arkiveret fra originalen 20. december 2016. Hentet 29. januar 2017. (engelsk)
Litteratur
- Tidwell, Thomas T. Ketenes Arkiveret 19. december 2013 hos Wayback Machine, 2. edition. John Wiley & Sons, 2006, ISBN 978-0-471-69282-9. (engelsk)
|
Medier brugt på denne side
Space-filling model of the ketene molecule
Ethenone