Cyklohexans konformation
Cyclohexans konformation er et meget studeret emne i organisk kemi på grund af det komplekse samspil mellem de forskellige konformationer af cyclohexan og derivater. Forskellige konformationer kan have forskellige egenskaber, herunder stabilitet og kemisk reaktivitet.
Historisk baggrund
Den allerførste antydning af, at cyklohexan ikke kan være et fladt molekyle går tilbage til en overraskende lang tid. I 1890 offentliggjorde den 28-årige assistent, Hermann Sachse, i Berlin instruktioner til at folde et stykke papir der repræsenterer to former for cyklohexan han kaldte symmetrisk og asymmetrisk (hvad vi nu ville kalde stolkonformation og bådkonformation). Han forstod tydeligvis, at disse former havde to forhold til brintatomer (igen, til at anvende moderne terminologi, aksial og ækvatorial), at to stolkonformationer sandsynligvis ville interkonvertere, og endda hvordan visse substituenter kan begunstige en af stolkonformationerne. Fordi han gav udtryk for alt dette i matematisk sprog, fostod kun få kemikere med tiden hans argumenter. Han havde flere forsøg på at offentliggøre disse idéer, men ingen lykkedes at fange den fantasi hos kemikere. Hans død i 1893 i en alder af 31 år betød, at hans ideer sank i glemmeselen. Det var først i 1918, da Ernst Mohr begyndte at bruge en meget ny teknik i røntgenkrystallografi, så han var i stand til at bestemme den molekylære struktur af diamant; det blev anerkendt, at Sachses stolkonformation var det afgørende motiv[1][2][3].
Stolkonformationen
På grund af den iboende tendens til sp3-hybridorbitaler (og dermed dens kulstof-hydrogenbindinger) om tetravalent kul til at danne bindingsvinkler på 109,5°, udgør cyklohexan ikke et planart sekskantet arrangement med indvendige bindingsvinkler på 120°. Stolkonformationen er en betegnelse for de mest stabile kemiske konformationer af seks-leddede enkeltbundede kulstof-ringe (gerne cyclohexan). Derek Barton og Odd Hassel delte begge nobelprisen for arbejdet med konformationer af cyklohexan og forskellige andre molekyler.
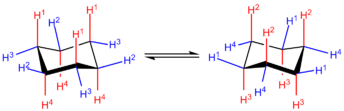
I lavest-energi-stolkonformationen er 6 ud af 12 brintatomer i aksial position (farvet rød); deres C-H-bindinger er parallelle med hinanden og ser ud til at holde op og ned fra ring-strukturen. De øvrige 6 i ækvatorial position (farvet blå), er spredte ud langs kanten af ringen.
Bådkonformationen
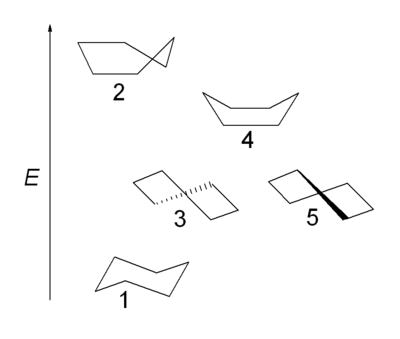
Ud over stolkonformationen (1) som har D3d-symmetri, kan cyclohexan også eksistere i formerne "halv-stol" eller konvolut (2), twist eller twist-bådkonformationerne (3,5) som har D2-symmetri og bådkonformationen (4). Kun twistkonformationen er det muligt at isolere, idet den, ligesom stolkonformationen, har energiminimum. Bådkonformationen har ikke vinkelstamme-problemet, men har et højere energiindhold end stolkonformationen på grund af sterisk pres som følge af de to aksiale 1,4-brintatomer i den såkaldte flagstangs-interaktion. Deformationen i bådkonformationen har en maksimal værdi, på grund af to af kulstof-bindingerne, der er overskyggede. Sammenlign dette med stolkonformationen, hvor alle bindinger er forskudt og der er fuldstændig mangel på deformation og twist-bådkonformation med 4 ud af 6 bindinger delvist formørket. I halv-stolen er 4 kulstofatomer placeret på et plan, hvor to bindinger er helt formørket.
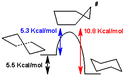
Båd- og stolkonformationerne er overgangstilstanden mellem twist-konformationen og stolkonformationen henholdsvis, og er umulige at isolere. Twist-bådskonformationen har 5,5 kcal/mol (23 kJ/mol), og er mindre stabil end stolkonformationen. Energierne af de to overgangstilstande er på 6,6 kcal/mol (28 kJ/mol) (båden) og 10,8 kcal/mol (45 kJ/mol) (halv-stolen), som højere end stolkonformationen[4]. Ringens overgangsproces kan nu beskrives mere præcist, som finder sted via en twist-bådkonformation og gennem to halv-stole-overgangsfaser.
Forskellen i energi mellem stolkonformationen og twist-bådkonformationen af cyklohexan kan måles indirekte ved at tage forskellen i aktiveringsenergi til omdannelse af stolkonformationen til twist-bådkonformationen og af den modsatte isomerisation. Koncentrationen af twist-bådkonformationen ved stuetemperatur er meget lav (mindre end 0,1%), men på 1073 kelvin kan denne koncentration kan nå op på 30%. Den modsatte reaktion måles ved IR-spektroskopi efter hurtig afkøling af cyklohexan fra 1073 K til 40 K, så man fryser cyklohexan, mens man har den store koncentration af molekyler med twist-bådkonformationen.
[6.6] Chiralan [5][6] er en punktgruppe T-molekyle, som udelukkende består af identiske smeltede twist-båd cyklohexan-molekyler. Twistan er et andet stof med en twist-bådkonformation.
Referencer
- ^ H. Sachse, Chem. Ber, 1890, 23, 1363; Z. Physik. Chem, 1892, 10, 203; Z. Physik. Chem., 1893, 11, 185-219.
- ^ E. Mohr, J. Prakt. Chem., 1918, 98, 315 og Chem. Ber., 1922, 55, 230.
- ^ Denne historie er pænt opsummeret her Arkiveret 7. juli 2010 hos Wayback Machine.
- ^ Konformationel Undersøgelse af cis-1,4-Di-tert-butylcyklohexan med Dynamisk NMR Spektroskopi og andre beregningsmetoder. Observation af Stol- and Twist-Bådsopbygninger Gill, G.; Pawar, D. M.; Noe, E. A J. Org. Chem. (Artikel); 2005; 70(26); 10726-10731. DOI: 10.1021/jo051654z Abstrakt
- ^ "http://www.mazepath.com/uncleal/chiral2.gif Chiralan". Arkiveret fra originalen 7. september 2009. Hentet 25. november 2009.
{{cite web}}: Ekstern henvisning i|title= - ^ "http://www.mazepath.com/uncleal/chiral3.gif". Arkiveret fra originalen 7. september 2009. Hentet 25. november 2009.
{{cite web}}: Ekstern henvisning i|title=
Medier brugt på denne side
(c) V8rik fra en.wikipedia.org, CC BY-SA 3.0
Twist-boat chair interconversion
Forfatter/Opretter: Cvf-ps, Licens: CC BY-SA 3.0
conformations of cyclohexane