CRISPR

CRISPR, Clustered Regularly Interspaced Short Palindromic Repeats[1], også omtalt under navnet CRISPR-Cas9, betegner en proces, der bruges af adskillige mikroorganismer som en forsvarsmekanisme bl.a. mod virusangreb, hvorved det fremmede genom ødelægges.[2][3][4]
CRISPR er blevet omtalt som “den genetiske schweizerkniv” fordi det er et generelt værktøj til genmodificering.[5] Derfor har CRISPR-teknologien fundet anvendelse bl.a. til studier og behandling af gendefekter og indenfor planteforædling, se f.eks.[6][7][8]
Emmanuelle Charpentier og Jennifer A. Doudna fik i 2020 Nobelprisen i kemi for “udvikling af en metode til redigering af genomer.”[9][10]
Historisk om CRISPR
- 2007: Under ledelse af Danisco indsættes resistensgen for bakteriofager i bakterier, der efterfølgende benyttes til fremstilling af diverse oste.
- 2012: Under ledelse af Emmanuelle Charpentier og Jennifer A. Doudna vækkes interessen for CRISPR. Forskergrupper fremviste at cas9 kan benyttes til at ændre specifikke dele af gener.
- April 2015: ændring af ikke-levedygtig embryo vha. modificeringsteknikken CRISPR under ledelse af Junjiu Huang.[11]
- 2018: den kinesiske forsker He Jiankui hævdede, at han havde ændret to babyers DNA med CRISPR-teknikken med henblik på at gøre dem resistente mod HIV ved at have modificeret genet for CCR5, genet for HIV-receptoren, hvilket udløste et stort negativt og advarende respons.[12] Efterfølgende har flere forskere påvist, at når CRISPR-teknikken anvendes på at ændre et gen, kan det medføre små såvel som store utilsigtede ændringer i genomet lige fra små ændringer omkring selve genet til eliminering af hele kromosomet.[13]
Metoden
Af menneskeheden anvendes CRISPR som en metode til genmodificering af diverse organismer. Metoden tager udgangspunkt i samme funktion som lymfocytters T-huskeceller under/efter aktiv immunisering. Inden for komplekse organismer er denne egenskab kendt, dog har der ikke tidligere været kendskab til at prokaryoter besidder lignende egenskaber. Bakterier skaber af den grund en RNA-streng identisk med virus', der sammen med vil binde sig til vira, på den måde ødelægges virus-DNA.[14] Idet bakterier bekæmper snyltende vira, indbygges en del af den indtrængende organismes DNA i bakteriens eget genom, såkaldt spacer DNA. Bakteriers genetiske hukommelse har ført til fundet af CRISPR. CRISPR, som teknologisk metode, tager udgangspunkt i CRISPR-komplekset, der er bestående følgende af tre hovedkomponenter:[2]
- Cas9: restriktionsenzym med egenskaber tilsvarende til helikase og nucleases funktioner. Bryder hydrogenbindinger mellem nitrogenholddige baser i DNA-strengen og katalyserer nedbrydning af DNA. gRNA, guide-RNA, er en gensekvens der matcher target-DNA, og som er sat sammen med cas9.
- crRNA (CRISPR RNA): sporer target-DNA. crRNA er komplementær med sekvensen, der ønskes at ændres.
- TracerDNA: fører til sammensætning af cas9 og crRNA.
CRISPR-kompleks bryder DNA, hvilket muliggør ødelæggelse af ufordelagtig mutationer og/eller indsætning af gener. Editering af genomet tager udgangspunkt i, at bruddet i DNA bevirker til mutationer der ødelægger sygdomsfremkaldende gener, knock-out. Desuden kan der biddrages med en såkaldt DNA-donor hvilket muliggør elitering og reparation.
Anvendelse
CRISPR bruges i dag til at modificere DNA og derved skabe genmodificerede organismer, GMO. Anvendelsesmulighederne er mange da metoden er økonomisk favorabel, samtidigt er CRISPR nem og hurtig.
- Planter: forbedring af primærproducentens egne egenskaber og/eller tilførsel mere fordelagtige egenskaber.
- Dyr: forbedring af dyre-racer, til fordel for menneskeheden.
- Mennesker: ved genterapi overføres gener til somatiske celler med det formål at helbrede sygdom, på den måde effektiviseres sygdomsbehandling.
Indsættelse af raske gener er vanskelig, da generne ikke nødvendigvis udtrykkes korrekt. Af den grund dannes der ikke passende mængder af genprodukt. Internationalt foretages ikke genterapi på gameter dog udføres der forskning inden for ændring af en embyros gener i forbindelse med in vitro fertilisation; positiv indvirkning på barnløshed. Dog forekommer der alternative og mindre risikable løsninger inden for barnløshed, disse løsninger er ægsortering, sæddonation og adoption, der kan finde sted uden genetisk konstruktion og ændring. I den forbindelse opstår der også et etisk dilemma ift. skabelsen af det perfekte menneske, gennem videnskabelig selektion inden for genetisk variation[15]
Se også
Referencer
- ^ Broad Institute of MIT and Harvard: "Genome engineering using CRISPR-Cas9 system."
- ^ a b Videnskab.dk: "Sådan fungerer CRISPR." - 26/04-2016.
- ^ Carnegie Institution for Science, Department of Plant Biology: "CRISPR-Cas systems in bacteria and archaea: versatile small RNAs for adaptive defense and regulation."
- ^ How the DNA revulution is changing us. National Geographic 2016
- ^ CRISPR: En genetisk schweizerkniv, som kan ændre menneskeheden for altid. Information 2018
- ^ CRISPR Gene Editing in the Kidney. American Journal of Kidney Diseases 2018
- ^ The CRISPR/Cas9 system for plant genome editing and beyond. Biotechnology Advances 2016
- ^ Her Discovery Changed the World. How Does She Think We Should Use It? New York Times 2022
- ^ Genetic scissors: a tool for rewriting the code of life. Kungl. Vetenskapsakademien 2020
- ^ »Fantastisk«: To kvinders udvikling af gen-saksen CRISPR hædres med Nobelprisen i kemi. Videnskab.dk 2020
- ^ Nature.com: "Chinese scientists genetically modify human embryos."
- ^ CRISPR Scientists Slam Methods Used on Gene-Edited Babies. The Scientist 2018
- ^ CRISPR Gene Editing Prompts Chaos in DNA of Human Embryos. The Scientist 2020
- ^ Ingeniøren.dk: "Ny klippeteknologi vil revolutionere biotek."
- ^ Videnskab.dk: "CRISPR"
|
Medier brugt på denne side
Forfatter/Opretter: James atmos, Licens: CC BY-SA 3.0
Diagram of the possible mechanism for CRISPR.
Forfatter/Opretter: Thomas Splettstoesser (www.scistyle.com), Licens: CC BY-SA 4.0
Type-I CRISPR RNA-guided surveillance complex (Cas, blue) bound to a ssDNA target (orange).
The type I surveillance complex in Escherichia coli is known as Cascade (CRISPR-associated complex for antiviral defense), a 405-kDa complex consisting of eleven subunits of five Cas proteins (Cse1, Cse2, Cas7, Cas5, and Cas6e) and a 61-nucleotide crRNA (also orange).
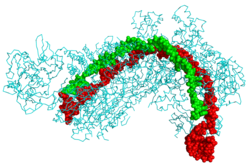
Based on PDB ID 4QYZForfatter/Opretter: Boghog, Licens: CC BY-SA 4.0
Crystal structure of a CRISPR RNA-guided surveillance complex, Cascade, bound to a ssDNA target. CRISPR system Cascade protein subunits CasA, CasB, CasC, CasD, and CasE (cyan) bound to CRISPR RNA (green) and viral DNA (red) based on PDB 4QYZ and rendered with PyMOL.