Brintoverilte
| Brintoverilte | ||||
|---|---|---|---|---|
 | ||||
| Generelt | ||||
| Systematisk navn | Hydrogenperoxid | |||
| Andre navne | Dioxidan, Brintoverilte | |||
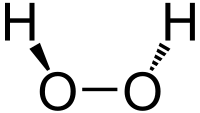
| Molekylformel | H2O2 | |||
| Molmasse | 34.0147 g/mol | |||
| CAS nummer | [7722-84-1] | |||
| PubChem | ||||
| Egenskaber | ||||
| Massefylde | 1.463 g/cm3 | |||
| Smeltepunkt | -0.43 °C | |||
| Kogepunkt | 150.2 °C | |||
| Syrestyrkekonstant (pKa) | 11.62 | |||
| Viskositet | 1.245 cP (20 °C) | |||
| Termokemi | ||||
| Standard molar varmekapacitet, cp | 2.619 J/g K (væske) | |||
| Sikkerhed | ||||
| MSDS | ICSC 0164 | |||
| NFPA 704 | ||||
| R-sætninger | R5, R8, R20/22, R35 | |||
| S-sætninger | S1/2, S17, S26, S28, S36/37/39, S45 | |||
| Beslægtede Stoffer | ||||
| Beslægtede stoffer | Hydrazin, Vand | |||
| Hvis ikke andet er angivet, er data givet for stoffer i standardtilstanden (ved 25 °C, 100 kPa) | ||||
Brintoverilte (H2O2, hydrogenperoxid) er den simpleste peroxid (stoffer med oxygen-oxygen enkeltbinding) og en stærk oxidant. I ren form er stoffet en farveløs væske med en smule højere viskositet end vand. I opløsning er det også farveløst. Grundet hydrogenperoxids oxidative egenskaber bruges det ofte som blegemiddel og til rensning samt som iltningsmiddel til bl.a. raketmotorer.
Celler, der benytter sig af oxidativ respiration, producerer hydrogenperoxid som et biprodukt. Stoffet er imidlertid cytotoxisk og afskaffes derfor vha. enzymet katalase, der nedbryder stoffet til vand (H2O) og oxygen (O2).
Brintoverilte har historisk været brugt til at desinficere sår, men det menes nu, at det paradoksalt hæmmer helingen. Der er folk, der påstår, at opløst brintoverilte kan tages oralt og intravenøst med gavnlig effekt på behandling af sygdomme - herunder kræft. Disse påstande har dog vist sig forkerte og farlige at følge, og det er tilmed ulovligt at tage brintoverilte oralt eller intravenøst i visse lande.
Nedbrydning
- 2 H2O2 → 2 H2O + O2
Denne proces er termodynamisk favorabel og har en standard-entalpiændring ΔHo på −98.2 kJ·mol−1 og en entropiændring ΔS på 70.5 J·mol−1·K−1.
Fremdriftsmiddel
Brintoverilte benyttes ofte til fremdrift af torpedoer fra undervandsbåde. Det menes, at en eksplosion i en torpedo på ubåden K-141 Kursk var årsag til, at den sank.
Brintoverilte blev brugt som iltningsmiddel til undervandsbåde med Walther-turbiner udviklet i Tyskland under 2. Verdenskrig. Disse var uafhængige af atmosfærisk luft.
Historie
Hydrogenperoxid blev først isoleret i 1818 af Louis Jacques Thénard; han lod bariumperoxid reagere med salpetersyre. En forbedret version af denne proces anvender saltsyre, efterfulgt af svovlsyre for at udfælde bariumchlorid-biproduktet.
Husholdningsanvendelse
- Hårblegning
- Tandblegning (frarådes af eksperter, da det bevirker, at emalien bliver porøs.)
- Ved kontakt med menneskelig hud opstår en kortvarig (~30-60 minutter lang), intens blegning af huden på grund af kapillær embolisme.
- Desinfektion
- Af sår (i svage opløsninger)(OBS vær opmærksom på cytotoxisk effekt.)
- Af halsen ved halsbetændelse
- Af kontaktlinser
Kemiske egenskaber
Hydrogenperoxid er en kraftig oxidant. Det overgås dog af fluor, hydroxylradikalet og ozon, men er kraftigere end kaliumpermanganat, klorin, klorindioxid m.fl.
| Spire Denne artikel om kemi er en spire som bør udbygges. Du er velkommen til at hjælpe Wikipedia ved at udvide den. |
Medier brugt på denne side
Chemistry, Chemical Template
Structure of hydrogen peroxide




