Biokemi
Biokemi (fra græsk βίος, bios, "liv", samt egyptisk kēme, "jord") er læren om kemiske processer i levende organismer. Biokemien omfatter studiet af struktur og funktion af cellulære komponenter såsom proteiner, lipider, kulhydrater og mange andre organiske molekyler.
Selvom der findes utroligt mange forskellige molekyler i levende organismer er mange af dem store, komplekse molekyler, der består af en lang række næsten ens enheder (kaldet monomerer), sat sammen til ét stort molekyle, en såkaldt polymer. Hver klasse af polymere biomolekyler udgøres af et forskelligt sæt monomerer; for eksempel er protein en polymer, der består af aminosyrer. Biokemien studerer vigtige biologiske molekylers kemiske egenskaber, med særligt fokus på enzym-katalyserede reaktioner.
Biokemien i cellers metabolisme og i det endokrine system er velbeskrevet. Andre områder indenfor biokemien er bl.a. den genetiske kode (i DNA og RNA), proteinsyntese, cellemembrantransport og signaltransduktion.
Denne artikel omfatter kun den biokemi, der findes på jorden, baseret på carbon og vand, fordi alle kendte livsformer der findes på jorden indeholder disse to stoffer. Alle levende organismer på jorden har de biokemiske træk til fælles svarende til at de antages at nedstamme fra det samme fælles ophav. Dette gælder også for forhold der lader til at være ganske tilfældige, såsom molekylers stereokemi. Det vides ikke om alternative biokemiske udformninger af liv er mulige.
Biokemiens historie

Man troede oprindeligt at liv ikke var underlagt videnskabens love på samme måde som ikke-levende ting er det. Man mente således, at kun levende væsener kunne producere de molekyler, der findes i levende organismer, ud fra andre eksisterende biomolekyler. Men i 1828 udgav Friedrich Wöhler en afhandling om syntesen af urinstof (urea), og beviste dermed at organiske molekyler kan skabes kunstigt.[1][2]
En anden vigtig opdagelse i den gryende videnskab biokemi var opdagelsen af det første enzym, diastase, – i dag kendt som amylase. Det blev i 1833 opdaget af Anselme Payen. Eduard Buchner var den første der demonstrerede en kompleks biokemisk proces uden for levende celler, i 1896; alkoholfermentation i ekstrakter af gærceller. Ordet biokemi har været brugt siden 1882, men den officielle navngivning tilskrives Carl Neuberg, en kemiker der anvendte begrebet fra 1903. Før da blev feltet typisk kaldt "fysiologisk kemi". Biokemien har siden haft store fremskridt, særligt fra midten af det 20. århundrede, med udvikling af nye teknikker inden for bl.a. kromatografi, røntgendiffraktion, isotopisk mærkning og elektronmikroskopi. Disse og andre nye teknikker har banet vejen for opdagelse og analyse af mange molekyler og molekylære mekanismer i cellen, f.eks. glykolysen og citronsyrecyklus.
I dag anvendes viden fra biokemien på mange områder, fra genetik til molekylærbiologi og fra landbrug til lægevidenskab.
Kulhydrater
Kulhydrater er en vigtig gruppe stoffer i biokemien, hvor de bl.a. fungerer som energilagringsstoffer og er med til at give levende organismer struktur. Der findes flere kulhydrater på jorden end nogen anden kendt type biomolekyle. Kulhydrater er en strukturel del af mange biologisk betydningsfulde molekyler: DNA, RNA, glycoproteiner som blodproteinerne og glycolipider. Kulhydrater har utallige vigtige biologiske funktioner, bl.a. i forbindelse med hormon-receptorernes funktion, ved cellernes indbyrdes kommunikation. Kulhydrater spiller også en rolle for virulensen af bakterier og virus og for uskadeliggørelsen af giftstoffer og affaldsstoffer. Kulhydrater modificerer mange molekylers funktion, således bestemmer kulhydrat-delen levetiden af de cirkulerende blodproteiner. Kulkydraternes kemi og biologi behandles i en ny disciplin, glykobiologi.
Monosakkarider
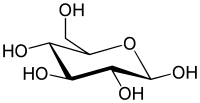
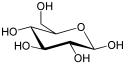
Den simpleste type kulhydrat er et monosakkarid, som indeholder carbon, hydrogen og oxygen, typisk i forholdet 1:2:1 (med den generelle formel CnH2nOn hvor n er et positivt helt tal større end 2). Glukose, et af de vigtigste kulhydrater, er et monosakkarid. Det samme gælder fruktose, som er stoffet, der giver mange frugter deres søde smag. Nogle kulhydrater (især efter kondensation til oligo- og polysakkarider) indeholder mindre carbon i forhold til hydrogen og oxygen, som dog bibeholder deres indbyrdes 2:1 forhold. Monosakkarider kan opdeles i aldoser, der indeholder en aldehydgruppe for enden af molekylet, og ketoser, der indeholder en ketongruppe et sted i molekylet (ikke for enden). Mange kulhydrater, både aldoser og ketoser, eksisterer i en kemisk ligevægt mellem en åben kædeform og en lukket ringform; der skal minimum være fire carbonatomer i kulhydratet før der kan dannes en ringform. Ringformen dannes ved at en af sukkerkædens hydroxylgrupper reagerer med aldehyd- eller ketongruppen og danner hhv. en hemiacetal eller hemiketal. Herved dannes enten en femleddet ring, der kaldes en furanosering, eller en seksleddet ring, der kaldes en pyranosering; begge er heterocykliske ringe, hvor der indgår et oxygenatom sammen med carbonatomerne.
Disakkarider

To monosakkarider kan sættes sammen ved en kondensationsreaktion, hvor et hydrogenatom fjernes fra det ene molekyle og en hydroxylgruppe fra det andet. Resten af dem er derefter bundet sammen, hvor atomerne blev fjernet, mens atomerne danner et vandmolekyle. Det dannede molekyle, der består af to monosakkarider, kaldes et disakkarid, og bindingen mellem de to monosakkarider er en glykosidbinding, en undergruppe af æterbindinger. Et disakkarid kan, ved forbrug af et vandmolekyle, omdannes til to monosakkarider; reaktionen er en såkaldt hydrolyse. Det mest kendte disakkarid er sucrose, almindeligt sukker. Sukrose består af et glukosemolekyle og et fruktosemolekyle sat sammen. Et andet vigtigt disakkarid er laktose, der består af et glukosemolekyle og et galaktosemolekyle. Hos mange mennesker falder produktionen af enzymet laktase, der hydrolyserer laktose til glukose og galaktose, med alderen. Dette giver laktoseintolerans
Sukkerpolymerer kan inddeles i to grupper efter hvorvidt deres to ender er i stand til at reducere andre stoffer i en redoxreaktion. Det afhænger af om det sidste monosakkarid i enden er i stand til at åbne sig fra ringformen og derved frigøre sin keton- eller aldehydgruppe, som så kan indgå i redoxreaktioner. Laktose har en ende, der kan reducere og en ende, der ikke kan, hvorimod sucrose ikke har nogen ende, der kan reducere.
Oligosakkarider og polysakkarider

Når nogle få (ca. 3-6) monosakkarider er forbundet, kaldes molekylet et oligosakkarid (hvor oligo betyder "få"). Disse molekyler bliver typisk brugt som signaler og markører i levende organismer.
Når mange monosakkarider er sat sammen, udgør de et polysakkarid. Monosakkariderne kan enten være sat sammen i én lang kæde, eller kæden kan være forgrenet. To af de mest almindelige polysakkarider er cellulose og glykogen, der begge består af glukose-monomerer. Cellulose dannes af planter og er en vigtig strukturel komponent i deres cellevægge. Dyr kan ikke danne cellulose, og kun specielt tilpassede dyr kan fordøje det. Glykogen findes derimod i alle dyr, hvor det bruges til midlertidig oplagring af energi.
Kulhydraters anvendelse som energikilde
Glukose er den vigtigste energikilde for de fleste levende væsner. Polysakkarider og disakkarider såsom laktose eller sukrose nedbrydes til monosakkarider før de metaboliseres. Enzymet glykogen fosforylase nedbryder ligeledes det midlertidige energilager glykogen til glukose, når der er mangel på energi.
Glykolyse (anaerob)
Glukose metaboliseres primært gennem en meget vigtig og evolutionært basal reaktionsvej på ti trin, der kaldes glykolysen. Glykolysen nedbryder samlet set et molekyle glukose til to molekyler pyruvat, og resulterer samtidig i dannelsen af to molekyler ATP (ud fra ADP og Pi) og to molekyler NADH fra NAD+. Glykolysen kræver ikke i sig selv oxygen, men hvis der ikke er oxygen til stede er cellen nødt til at gendanne NAD+ ved en forgæring. I mennesker dannes der mælkesyre ved en sådan forgæring, mens gær f.eks. kan danne ethanol og carbondioxid. Andre monosakkarider, f.eks. fruktose og galaktose, kan omdannes til nogle af de stoffer, der indgår i glykolysen og metaboliseres på den måde.
Aerob
I celler med tilstrækkeligt med oxygen, såsom de fleste celler i mennesker, metaboliseres det dannede pyruvat videre. Det omdannes irreversibelt til acetyl-CoA, og afgiver et carbonatom med affaldsproduktet CO2. Desuden dannes der endnu et molekyle NADH ud fra NAD+. De to molekyler acetyl-CoA fra et molekyle glukose indgår derefter i citronsyrecyklus, hvor de giver to molekyler ATP, seks molekyler NADH og to molekyler FADH2, mens resten af carbonatomerne frigives som CO2. Det dannede NADH og FADH2 føres derpå ind i elektrontransportkædens enzymsystem, hvor elektronerne overføres en række gange og i sidste ende til oxygen. Energien herfra anvendes til at opbygge en gradient af protoner over en membran (den indre mitokondrielle membran i eukaryoter). Oxygen reduceres ved denne proces til vand, og de oprindelige elektronacceptorer NAD+ og FAD gendannes. Dette er årsagen til at mennesker og dyr indånder oxygen og udånder CO2. Den opbyggede protongradient anvendes til at danne ATP via enzymet ATP-syntase. Ideelt set kan der på denne måde frembringes 28 molekyler ATP fra et molekyle glukose, udover de 4 fra glykolyse og citronsyrecyklus. Dette illustrerer hvordan der tydeligvis kan høstes meget mere energi ved at oxidere glukose fuldstændigt end ved nogen oxygen-uafhængig metabolisering, og dette menes at være årsagen til, at højere livsformer først opstod efter jordens atmosfære fik et stort indhold af oxygen.
Glukoneogenese
Ved mangel på oxygen kan visse celler i stedet skifte til anaerobisk metabolisme, hvor glukose i stedet fermenteres (forgæres) til mælkesyre; det gælder f.eks. i menneskers skeletmuskulatur under hård fysisk træning. Den dannede mælkesyre føres til leveren, hvor glukose gendannes ved en proces kaldet glukoneogenese. Denne proces er næsten det modsatte af glykolyse, men der er visse forskelle. Glukoneogenese kræver op mod tre gange så meget energi for at gendanne glukose, som glykolysen giver ved at nedbryde glukose.
Proteiner
Proteiner er en anden vigtig stofgruppe, der omfattes af biokemien. Ligesom det er tilfældet for kulhydrater udfylder nogle proteiner primært strukturelle roller. Det er f.eks. bevægelse af de strukturelle proteiner actin og myosin, der fører til sammentrækning af muskler. En typisk egenskab som mange proteiner udviser, er evnen til at binde specifikt til et bestemt molekyle eller en gruppe af molekyler. Proteiner kan være ekstremt selektive med hensyn til det, som de binder til, og antistoffer er et godt eksempel. ELISA, en test der anvender antistoffer, er en af de mest følsomme instrumenter, der findes til at detektere biomolekyler. Den vigtigste type protein er dog nok enzymer. Stort set alle enzymer er proteiner, og disse bemærkelsesværdige molekyler er i stand til at genkende specifikke molekyler, kaldet substrater, og katalysere kemiske reaktioner mellem dem. Enzymer sænker de kemiske reaktioners aktiveringsenergi, hvilket kan øge en reaktions hastighed med så meget som en faktor 1011; en reaktion der normalt ville tage 3.000 år kan på denne måde forløbe på under et sekund med et enzym til at katalysere den. Enzymet selv forbruges ikke i processen, og det er i stand til at gentage reaktionen med et nyt sæt substrater utallige gange. Enzymers aktivitet kan reguleres på en række måder, hvilket tillader levende celler at kontrollere deres biokemi som helhed via enzymer.
Proteiner er basalt set kæder af aminosyrer. En aminosyre består af et carbonatom bundet til fire grupper. En af dem er en aminogruppe, den anden er en carboxylsyregruppe, den tredje er et hydrogenatom og den fjerde, der ofte benævnes R, er forskellig for hver aminosyre. Der er tyve aminosyrer, der som standard indgår i proteiner i stort set alt liv. Nogle af dem har, ud over at indgå i proteiner, funktioner i sig selv eller i modificeret form; for eksempel kan glutaminsyre fungere som en neurotransmitter.

Aminosyrer kan sættes sammen med en peptidbinding. Dannelsen af en peptidbinding er en kondensationsreaktion, hvor et vandmolekyle fjernes, og kvælstofatomet i den ene aminosyres aminogruppe bindes til carbonatomet i den anden aminosyres carboxylsyregruppe. Det dannede molekyle kaldes et dipeptid, mens små kæder af aminosyrer (typisk op til ca. 30) kaldes peptider eller polypeptider. Længere kæder kaldes proteiner. Eksempelvis indeholder det vigtige plasmaprotein albumin 585 aminosyrerester. Når aminosyrer er bundet sammen af peptidbindinger omtales de som aminosyrerester, fordi nogle af atomerne fjernes når peptidbindingerne dannes.
Proteiners struktur beskrives traditionelt i et hierarki på fire niveauer. Proteiners primære struktur er den lineære sekvens af aminosyrer, f.eks. "methionin-glycin-valin-phenylalanin-glycin-...". Proteiners sekundære struktur beskriver lokal morfologi, med specielle mønstre af sammenfoldning af aminosyrekæden; visse sekvenser vil folde sig til en skrueformm der kaldes en alfahelix, og andre sekvenser vil folde sig til en pladelignende struktur, der kaldes et betasheet. Proteiners tertiære struktur er hele aminosyrekædens tredimensionelle form og foldning, og bestemmes ligesom den sekundære struktur af aminosyresekvensen; en enkelt ændring kan ofte ændre hele strukturen markant. Et eksempel på det er, at ændring af en af de 146 aminosyrerester i hæmoglobins beta-kæde fra glutaminsyre til valin, ændrer proteinets opførsel så meget, at det medfører seglcelle-anæmi. Det sidste niveau af struktur er den kvaternære struktur, som angiver strukturen og formen af proteiner, der består af flere peptidkæder, der sætter sig sammen, som f.eks. hæmoglobin med dets fire subunits. Ikke alle proteiner har subunits, men det er ganske udbredt.
Når proteiner indtages, nedbrydes de til enkelte aminosyrer eller dipeptider i tyndtarmen, og optages. Derefter kan de sættes sammen til nye proteiner i kroppen. Diverse molekyler, der indgår i glykolysen, citronsyrecyklus og pentosefosfat-reaktionsvejen, kan bruges til at danne de tyve aminosyrer, der indgår i proteiner, og de fleste bakterier og planter har alle de enzymer, der skal til for at danne aminosyrerne på denne måde. Mennesker og andre pattedyr kan dog kun danne halvdelen af aminosyrerne selv; de kan ikke danne de essentielle aminosyrer, og er derfor nødt til at få disse aminosyrer gennem kosten.
Hvis aminogruppen fra en aminosyre fjernes, efterlades en såkaldt α-ketosyre. Transaminase-enzymer kan flytte aminogruppen fra en aminosyre (som bliver til en α-ketosyre) til en α-ketosyre (som bliver til en aminosyre). Dette er vigtigt i aminosyrers biosyntese, da mange af syntesevejene danner α-ketosyrer, der derefter modtager en aminogruppe og bliver til en færdig aminosyre.
En tilsvarende proces anvendes til at nedbryde proteiner. Proteinet hydrolyseres først til dets enkelte aminosyre. Fri ammoniak (NH3), der i blodet vil optræde som ammoniumioner (NH4+), er giftigt. Der kræves derfor en passende metode til at skaffe sig af med det. Forskellige strategier har udviklet sig i forskellige dyr, afhængig af dyrets behov. Encellede organismer udskiller blot ammoniakken i miljøet. På samme måde kan benfisk bare udskille ammoniak i vandet, hvor det hurtigt bliver fortyndet. Pattedyr omdanner ammoniakken til urea (urinstof), via en ureacyklus; dette stof er meget mindre giftigt, og kan derfor opbevares i koncentreret form i urinen, så dyret ikke behøver tisse så ofte. Fugle og mange krybdyr omdanner i stedet ammoniakken til urinsyre, der er uopløseligt i vand. For fugle betyder det, at de ikke behøver at opbevare kvælstofaffaldet opløst i vand, og at de derfor kan spare vandets vægt.
Lipider
Stofgruppen lipider omfatter en bred vifte af forskellige molekyler, og er til dels en uspecifik fællesbetegnelse for biologiske stoffer med lav opløselighed i vand, som bl.a. omfatter voks, fedtsyrer, fedtsyreafledte fosfolipider, sphingolipider, glykolipider og terpenoider (herunder steroider). Nogle lipider er lineære alifatiske molekyler, hvorimod andre indeholder ringstrukturer. Nogle er aromatiske, mens andre ikke er det. Nogle er fleksible molekyler, andre er rigide.
De fleste lipider har en vis grad af polære egenskaber, selvom de hovedsageligt er upolære. Det er typisk, at det meste af deres struktur er upolær, hvilket betyder at den del af molekylet har vanskeligt ved at interagere med polære opløsningsmidler, såsom vand. En anden del af stofferne er polær, og vil derfor have tendens til at holde sig til polære opløsningsmidler, såsom netop vand. Lipidernes indhold af både polære og upolære dele betyder, at de er amfifile (eller amfipatiske). Hvor stor de polære og upolære dele af molekylet er kan variere; i kolesterol er den polære del kun en enkelt hydroxylgruppe, mens fosfolipider har væsentlig større og mere polære grupper.
Nukleinsyrer
Nukleinsyrer (eller kernesyrer) er komplekse biologiske makromolekyler med høj molekylvægt, der består af kæder af nukleotider. De anvendes til at overbringe genetisk information i alle levende organismer samt virus (der normalt ikke anses for levende). De vigtigste og langt mest almindeligt forekommende nukleinsyrer er deoxyribonukleinsyre (DNA) og ribonukleinsyre (RNA).
Nukleinsyrernes navn kommer af, at de typisk findes i størst mængde i cellekernen (nukleus). Nukleinsyrerne er biologiske polymerer, og de enkelte monomerer er nukleotider. Hver nukleotid består af tre dele; en kvælstofholdig heterocyklisk base (enten en purin eller en pyrimidin), en pentose-sukker, og en fosfatgruppe. Forskellige nukleinsyrer adskiller sig ved det sukkermolekyle, der indgår i kæden (f.eks. ribose i RNA), og ved, at der optræder forskellige baser i nukleotiderne. Adenin, cytosin og guanin optræder både i RNA og DNA, hvorimod thymin kun findes i DNA og uracil kun findes i RNA.
Fodnoter
- ^ Wöhler, F. (1828). "Ueber künstliche Bildung des Harnstoffs". Ann. Phys. Chem. 12: 253-256.
- ^ Kauffman, G. B. and Chooljian, S.H. (2001). "Friedrich Wöhler (1800–1882), on the Bicentennial of His Birth". The Chemical Educator. 6 (2): 121-133. doi:10.1007/s00897010444a. ISSN 1430-4171.
{{cite journal}}: CS1-vedligeholdelse: Flere navne: authors list (link)
Eksterne henvisninger
- Biokemisk leksikon, Biosite
- Danske bio-medicinske links
- The Virtual Library of Biochemistry and Cell Biology (engelsk)
- Biochemistry, 5th ed. Fuld tekst af lærebog af Berg, Tymoczko og Stryer, til rådighed takket være National Center for Biotechnology Information (NCBI). (engelsk)
- Biochemistry, 2nd ed. Arkiveret 5. juli 2008 hos Wayback Machine Fuld tekst af lærebog af Garrett og Grisham. (engelsk)
- Cell Biochemistry (engelsk)
- Danske virksomheder indenfor det bio-medicinske område
Se også
Medier brugt på denne side
Forfatter/Opretter: Magnus Manske at engelsk Wikipedia, Licens: CC BY-SA 3.0
Generic amino acids (1) in neutral form, (2) as they exist physiologically, and (3) joined as a dipeptide.
(c) Zephyris fra en.wikipedia.org, CC BY-SA 3.0
By Richard Wheeler (Zephyris) 2007.
Created with en:pymol from en:PDB enzyme 1GZX.
en:Category:Protein images