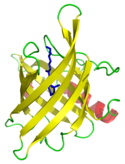
Beta-barrel




En beta-barrel er den almindelige betegnelse for en protein-struktur, på dansk en beta-tønde, der er et beta-sheet formet som en cylinder og som derved danner en lukket struktur, hvor den første beta-tråd er bundet til den sidste beta-tråd med hydrogenbindinger. Beta-tråde i beta-tønder er typisk arrangeret som antiparallelle peptidkæder.[1]
Tøndestrukturer forekommer i bakterier, mitokondrier og grønkorn som membranproteiner (poriner, der tillader molekyler at passere membranen) og i bakterie og eukaryoter som calyciner, en strukturel superfamilie af proteiner, der binder og transporterer hydrofobe molekyler: lipocaliner (ligand-bindende proteiner klassificeret som transportproteiner), FABP (fedtsyre-bindende proteiner) og avidiner (binder biotin, vitamin B7. Tønde-strukturer som poriner udgør 2-3% af generne i Gram-negative bakterier. Det enestående sammenfald, at membranproteiner med beta-barrel-struktur kun er fundet i bakterier, mitokondrier og grønkorn, leverer et stærkt indicium på at mitokondrier og grønkorn er opstået ved symbiose mellem en bakterie og en celle.
Den specielle struktur
Bakteriers ydre membran indeholder proteiner med beta-barrels med mellem 8 og 22 beta-tråde.
I mange tilfælde finder man at beta-trådene består af vekslende polære og hydrofobe aminosyrer:
- for lipocaliner er de hydrofobe aminosyrerester orienteret ind i det indre af tønden for at danne en hydrofob kerne til binding af en hydrofob ligand og de polære aminosyrerester er orienteret mod ydersiden af tønden på den eksponerede overflade.
- for poriner og andre membran proteiner er det lige omvendt: de hydrofobe aminosyrerester er orienteret mod membranen, hvor de er i kontakt med de omkringliggende lipider, og de hydrofile aminosyrerester er orienteret mod den indre pore.
Også planter har molekyler med beta-tønder. I hver monomer af det tetramere lektin GNL (Galanthis nivalis agglutinin, vintergæk-lektinet) er tre beta-ark hver bestående af fire antiparallelle tråde arrangeret som en 12-trådet beta-tønde med tre bindingssæder for kulhydrat (α-D-mannose).[2]
TOM
Et eksempel på et membranprotein med en beta-barrel er Tom40 som er en del af TOM-komplekset. TOM-komplekset er den primære port for proteiner i mitokondriernes ydre membran, og TOM-komplekset sørger for translokationen af proteiner fra cytoplasmaet til mitokondrierne. TOM står for "translocator in the outer membrane", engelsk for "translokator i den ydre membran". Over 90% af mitokondrie-proteinerene produceres i cytoplasmaet og det indre af Tom40 danner den kanal som er den primære port for disse proteiner til mitokondrierne og sørger for at proteinerne kommer ind i IMS. I mitochondriernes indre membran findes andre porte, der hver især sørger for translokationen af bestemte klasser af proteiner ind i mitokondriet
Tom40 er et transmembran-protein med 19 antiparallelle beta-tråde i membranen med den første og sidste beta-tråd som parallelle peptidkæder. TOM-komplekset består af flere transmembrane proteiner: Tre Tom40 omkring en kerne af tre Tom22 plus seks Tom5 og tre Tom6 udover ni ikke-transmembrane Tom20.[3]
Se også
Henvisninger og eksterne links
- ^ Structural insight into the SAM-mediated assembly of the mitochondrial TOM core complex. Science 2021
- ^ Structure of mannose-specific snowdrop (Galanthus nivalis) lectin is representative of a new plant lectin family. Nature structural & molecular biology 1995)
- ^ Molecular architecture of the active mitochondrial protein gate, Science, 2016
- What membrane proteins look like. Stockholms Universitet Arkiveret 4. februar 2012 hos Wayback Machine
Medier brugt på denne side
Forfatter/Opretter: Opabinia regalis, Licens: CC BY-SA 3.0
Side view of a single monomer of a sucrose porin protein from the bacterium Salmonella typhimurium, illustrating the canonical antiparallel beta barrel structure. Porins are transmembrane proteins that facilitate transfer of small molecules such as sucrose that are polar or charged and therefore cannot diffuse through the hydrophobic cell membrane.
Forfatter/Opretter: Kbelardo, Licens: CC BY-SA 4.0
mVDAC1 side view showing antiparallel beta strands
Forfatter/Opretter: Kbelardo, Licens: CC BY-SA 4.0
mVDAC1 structure showing a top down view of the pore and the alpha helix in the center
Forfatter/Opretter: Opabinia regalis, Licens: CC BY-SA 3.0
Human retinol-binding protein (RBP) in complex with retinol, illustrating the canonical eight-stranded beta-barrel lipocalin structure.