Benzyl
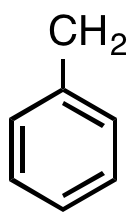
I organisk kemi er en benzyl er substituent eller molekylært fragment som har strukturen C6H5CH2-. Benzyl indeholder en benzenring som sidder fast på en CH2-gruppe.[1]
Nomenklatur
I IUPAC nomenklatur refererer præfikset benzyl til en C6H5CH2 substituent, for eksempel benzylchlorid eller benzylbenzoat. Benzyl skal ikke forveksles med phenyl med formlen C6H5. Begrebet benzylisk bliver brugt til at beskrive placeringen af det første carbon, der er bundet til en benzen eller anden aromatisk ring. For eksempel kan et molekyle blive refereret til som en "benzylisk" carbocation. Det frie benzylradikal har formlen C6H5CH2. Benzyl carbocationen har formlen C6H5CH2+; carbanionen har formlen C6H5CH2-. Ingen af disse specier bliver dannet i væsentligt mængder under normale betingelser, men de er nyttige referencestoffer ved undersøgelse af reaktionsmekanismer.
Forkortelser
Forkortelsen "Bn" benyttes hyppigt til at betegne benzylgrupper i nomenklaturer og ved afbildninger af strukturer af kemiske forbindelser. For eksempel kan benzylalkohol bliver repræsenteret som BnOH. Denne forkortelse skal ikke forvekslesl med "Bz", som er forkortelsen for benzoylgruppen C6H5C(O)- eller phenylgruppen C6H5 med forkortelsen "Ph".
Reaktivitet af benzyliske centre
Den forbedrede reaktivitet i benzylringen blive tilskrevet den lave bindingsdissociationsenergi for benzylisk C-H-bindinger. Særligt C6H5CH2-H-bindingen er omring 10-15% svagere end andre slags C-H-bindinger. Den aromatiske naboring stabliserer benzylradikaler. Dataen i tabellen neden sammenligner benzyliske C-H-bindinger med relaterede C-H-bindingsstyrker.
| Binding | Binding | Bindingsdissociationsenergi | Kommentar | |
|---|---|---|---|---|
| (kcal/mol) | (kJ/mol) | |||
| C6H5CH2-H | benzylisk C–H-binding | 90 | 377 | akin til allylisk C–H-binding disse bindinger viser øger reaktivitet |
| H3C–H | Methyl C–H-binding | 105 | 439 | En af de stærkeste aliphatiske C-H-bindinger |
| C2H5-H | Ethyl C–H-binding | 101 | 423 | Lidt svagere end H3C–H |
| C6H5-H | phenyl C–H-binding | 113 | 473 | Sammenlignelig med vinylradikal, sjælden |
| CH2=CHCH2-H | allyliisk C–H-binding | 89 | 372 | Disse binding vier øget reaktivitet |
De svage C-H bindinger viser stabiliteten af benzylradikalet. Af samme årsager udviser benzylsubstituenter øget reaktivitet ved oxidation, fri radikal halogenering eller hydrogenolyse. Som et praktisk eksempel oxideres p-xylen udelukkende ved den benzyliske ende for at give terephthalsyre under tilstedeværelse af en passende katalysator:
- CH3C6H4CH3 + 3 O2 → HO2CC6H4CO2H + 2 H2O
Flere millioner af tons terephthalsyre bliver produceret årligt med denne metode.[2]
Benzyl beskyttelsesgrupper
Benzylgrupper bliver ofte brugt i organisk syntese som beskyttelsesgrupper til alkoholer og carboxylsyrer.
To almindege metoder til benzylether beskyttelse:
- reaktion med alkohol og benzylbromid og en stærk base som eksempelvis natriumhydrid, som det sker i Williamson ethersyntese[3]
- reaktion med alkohol og imidat som eksempelvis benzyl trichloroacetimidat (C6H5CH2OC(CCl3)=NH) fremmet af trifluoromethanesulfonsyre. Et eksempel som danne en p-methoxybenzyl (PMB) ether i totalsyntese:[4]
Benzylgruppen kan blive fjernet ved hydrogenering. PMB-ethere kan blive kløvet af magnesiumbromid –dimethylsulfid, CAN eller DDQ.[5]
Et studie[6] bruger benzyloxy pyridinsalt som en benzyl transfer-reagent til alkoholer:
Trifluorotoluen blev brugt som solvent under tilstedeværelse af magnesiumoxid som en syre scavenger. Reaktionstypen for denne omdannelse antages at være SN1 baseret på tilstedeværelsen af spormængder af Friedel-Crafts reaktion biprodukter med toluen som solvent.
Referencer
- ^ Carey, F. A., and Sundberg, R. J.; Advanced Organic Chemistry, Part A: Structure and Mechanisms, 5th ed.; Springer: New York, NY, 2008. pp 806–808, 312–313.
- ^ Richard J. Sheehan, "Terephthalic Acid, Dimethyl Terephthalate, and Isophthalic Acid" in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim, 2002.
- ^ DeSelms, R. H.; Benzyl Phenyl Ether Compounds Arkiveret 3. oktober 2011 hos Wayback Machine; Enigen Science Publishing: Washington, DC, 2008.
- ^ Total synthesis of rutamycin B via Suzuki macrocyclization James D. White, Thomas Tiller, Yoshihiro Ohba, Warren J. Porter, Randy W. Jackson, Shan Wang, and Roger Hanselmann 80 Chem. Commun., 1998
- ^ Protecting groups Krzysztof Jarowicki and Philip Kocienski J. Chem. Soc., Perkin Trans. 1, 1998, 4005–4037 4005
- ^ K. W. C. Poon and G. B. Dudley (2006). "Mix-and-Heat Benzylation of Alcohols Using a Bench-Stable Pyridinium Salt". J. Org. Chem. 71 (10): 3923-3927. doi:10.1021/jo0602773. PMID 16674068.
Medier brugt på denne side
Forfatter/Opretter: Pendragoness (talk)Constance Bailey, Licens: Attribution
PMB protection of an alcohol, ChemDraw
(c) V8rik fra en.wikipedia.org, CC BY-SA 3.0
Pyridinium_salt_benzyl_ether_protection




