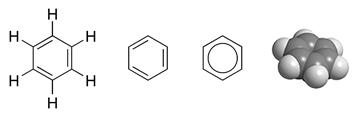
Benzen
| Benzen | |
|---|---|
| Synonymer | [6]Annulen, benzol |
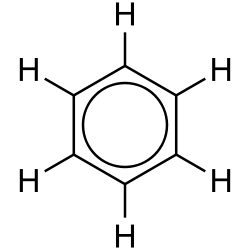
| Struktur |  |
| Sumformel | C6H6 |
| Farve | Farveløs |
| Fysiske egenskaber | |
| molvægt | 78,11 g/mol |
| Smeltepunkt | 5,5°C |
| Kogepunkt | 80,0 °C |
| Massefylde | 0,8756 g/cm3 (20 °C) |
| Dannelsesenthalpi | 49,0 kJ/mol (væske, 25 °C) |
| Varmekapacitet Cp | 136,3 J/mol*K (25 °C) |
Diverse | |
| CAS-nummer | 71-43-2 |
| E-nummer | |
Den kemiske forbindelse benzen (også benzol, C6H6) er en farveløs, brændbar aromatisk kulbrinte, der beviseligt er kræftfremkaldende. Stoffet kan fremstilles ved reduktion af visse kulstofforbindelser eller ud fra olie. Det bruges ved syntetisk fremstilling af stoffer som visse lægemidler, plastic, benzin, kunstgummi, napalm og farvestoffer, enten som reaktant eller som opløsningsmiddel.
Historie
Benzen blev opdaget i 1825 af den britiske kemiker Michael Faraday, som fremstillede det i ren form ud fra naturgas og gav det navnet brintbikarburat. I 1833 producerede den tyske kemiker, Eilhard Mitscherlich, stoffet ved destillation af benzoesyre og brændt kalk. Han gav det navnet benzin. I 1849 indledte Charles Mansfield den første, industrielle produktion af benzen ud fra kultjære.
Struktur
Benzens grundstofsammensætning (C6H6) var et mysterium i en periode efter stoffets opdagelse, fordi ingen af de strukturformler, der blev foreslået, kunne forklare dets bindinger, da kulstof sædvanligvis danner fire bindinger og brint kun én. En struktur der blev foreslået, var en cyclisk struktur bestående af de seks kulstofatomer, hvor hver anden binding var en enkeltbinding og hver anden en dobbeltbinding:

Denne struktur passede imidlertid ikke med eksperimentelle data fra Røntgen-diffraktion, som havde vist, at alle kulstof-kulstof bindinger var lige lange. Disse data havde ydermere vist, at længden af en C-C binding i benzen var kortere end en C-C enkeltbinding, men længere end en C=C dobbeltbinding.
Løsningen ligger i at betragte bindingerne som elektronbaner, orbitaler. Det følgende diagram viser placeringen af disse orbitaler:
Da orbitalerne ligger uden for atomernes plan, kan de frit påvirke hinanden, så de bliver forskudt. Det betyder, at i stedet for at elektronen er bundet til ét kulstofatom, deles alle de seks kulstofatomer om den. Der er altså ikke nok til at danne dobbeltbindinger på alle kulstofatomerne, men de "ekstra" elektroner styrker til gengæld alle bindinger i ringen ligeligt. Dette er et eksempel på delokaliserede elektroner. Den dannede molekylære orbital har π-symmetri.
Denne type forskydning af elektroner kaldes aromatisk, og den giver benzen stor stabilitet. Det er den grundlæggende egenskab ved aromatiske stoffer i modsætning til de ikke-aromatiske.
For at vise bindingernes forskudte natur på strukturdiagrammer, kan man tegne benzen som en cirkel inden i en sekskant. Det er dog meget brugt at udelade brintatomerne fra diagrammet.
Benzen optræder så ofte i organiske molekyler, at det har fået sit eget Unicode-symbol: ⌬
Substitueringer
Mange vigtige kemiske forbindelser indeholder benzen, hvor ét eller flere brintatomer er erstattet af andre atomer eller grupper, f.eks.:
Kulbrintegrupper
Andre funktionelle grupper
- trinitrotoluen (sprængstoffet TNT)
- fenol
- pikrinsyre
- anilin
- hexachlorbenzen HCB, PCB
Polycykliske forbindelser
- naftalen
- anthracen
- fenantren
Heterocykliske ringe – et eller flere kulstofatomer i ringen er erstattet med et andet grundstof, ofte kvælstof
Anvendelser
Før 1920'erne blev benzen ofte brugt som opløsningsmiddel i industrien, og ganske særligt til affedtning af metal. Da man blev klar over, hvor giftigt stoffet er, blev benzen erstattet af andre midler i de anvendelser, hvor mennesker var direkte udsat for dampene.
Brugt som tilsætningsstof i benzin giver benzen et højere oktantal, der forhindrer bankning i motoren. I løbet af 1950'erne gik man i stedet over til at bruge tetraetylbly, men den stigende blyforurening gjorde, at man nu til dags atter bruger benzen som additiv i motorbenzin, som sælges med et indhold på max 1 %.
Langt den vigtigste anvendelse af benzen er dog som udgangspunkt for syntesen af andre stoffer. Blandt de mest brugte benzenderivater kan nævnes styren, der bruges i polymeriseret form til fremstilling af plastic (polystyren), fenol, der bruges til fremstilling af kunstharpiks og klæbestoffer, og cyclohexan, der bruges til fremstilling af nylon. Mindre mængder af benzen bruges til fremstilling af gummi, smøremidler, farvestoffer, rensemidler, medicin, sprængstoffer og bekæmpelsesmidler.
Sundhedsrisici
Benzen har både akut og kronisk giftvirkning på mennesker. Ved indånding af dampene bliver man søvnig, svimmel, forvirret og får hurtig puls. I alvorlige tilfælde kan man miste bevidstheden eller dø af dampene. Indtager man stoffet i føden, fremkalder det opkastning, maveirritation, svimmelhed, søvnighed, kramper, høj puls eller i værste fald: død.
Ved lang tids belastning med stoffet opstår der skader på knoglemarven, anæmi, svækkelse af immunforsvaret og øget risiko for infektioner. Fostre kan skades, så de får lav fødselsvægt, forsinket knogleudvikling og knoglemarvskader. Det amerikanske sundhedsministerium har yderligere afgjort, at stoffet er kræftfremkaldende, idet det kan forårsage leukæmi.
Af disse grunde har et EU-direktiv fra 2000 fastlagt grænseværdier for benzen og kulilte (Europa-Parlamentets og Rådets direktiv 2000/69/EF af 16. november 2000 om grænseværdier for benzen og carbonmonoxid i luften. EF-Tidende L 313 af 13.12.2000 s.12 ): Der er fastsat en grænseværdi på 5 µg/m³ målt som årsgennemsnit.
Eksterne henvisninger
 | Wikimedia Commons har medier relateret til: |
- Benzens struktur Arkiveret 2. januar 2009 hos Wayback Machine
|
| Infoboks uden skabelon Denne artikel har en infoboks dannet af en tabel eller tilsvarende. |
Medier brugt på denne side
Forfatter/Opretter: An elite, Licens: CC BY-SA 3.0
Benzene molecule. Hydrogen atoms are shown, and π bonds are shown as delocalized.
Forfatter/Opretter: Tango Project], Gnome, og VisualEditor team, Licens: GPL
Icon used to indicate a list