Atom
 Denne artikel omhandler en kemisk bestanddel. Opslagsordet har også en anden betydning, se Atom (programmering).
Denne artikel omhandler en kemisk bestanddel. Opslagsordet har også en anden betydning, se Atom (programmering).

Atom er et grundlæggende begreb i fysikken og kemien. Et atom udgør den absolut mindste del af et grundstof. Et atom kan eksistere selvstændigt, men er oftest bundet til andre atomer, der enten kan tilhøre det samme grundstof eller andre grundstoffer,[1] hvorved der dannes et molekyle.
Etymologi
Ordet atom stammer fra det oldgræske ord ἄτομος (átomos), der betyder udelelig.[2] Ordet er en sammensætning af det negative præfiks "a-" med "τομή," ordet for skære, og átomos kan derfor oversættes til "ikke skærbar" eller ”udelelig”.
Historie
Demokrits atomteori
Demokrit (/dɪˈmɒkrɪtəs/; græsk: Δημόκριτος, Dēmókritos, der betyder "udvalgt af folket"; (ca. 460- ca.370 f.Kr.)) var en oldgræsk præ-sokratisk filosof fra Abdera, der primært huskes i dag for sin formulering af, hvad der menes at være den første atomteori.[3][4] Ifølge Demokrits hypotese er alt i verden sammensat af små enheder, som han kaldte "átomos".[3]
Ifølge Demokrits teori er atomer fysisk udelelige; desuden antages det, at der mellem atomer er et tomt rum; at atomer er uforgængelige og at de altid har været og altid vil være i bevægelse; at der er et uendeligt antal atomer og at der er forskellige slags atomer, som varierer med hensyn til form og størrelse. Demokrit foreslog sammen med Leucippus og Epikur de tidligste teorier om atomers former og forbindelse. De ræsonnerede, at et materiales fasthed bestemtes af formen på de involverede atomer.[5] Desuden blev forbindelser mellem atomer forklaret med at de enkelte atomer var forsynet med vedhæftninger: nogle med kroge og øjne, andre med kugler og fatninger, der muliggjorde at de kunne knyttes til hinanden.[5] Om massen af atomer sagde Demokrit: "Jo større en udelelig er, jo tungere er den".[6]
Det er vanskeligt at adskille Demokrits bidrag fra de bidrag hans mentor Leukippos kom med, da de ofte nævnes sammen i tekster. Deres spekulationer om atomer, hentet fra Leukippos, har en forbigående og delvis lighed med det 19. århundredes forståelse af atomstruktur, hvilket har fået nogle til at betragte Demokrit som mere en videnskabsmand end andre græske filosoffer; dog hvilede deres ideer på meget forskellige grundlag.[5] De antikke ideer var baseret på filosofiske ræsonnementer, snarere end på resultaterne af videnskabelige forsøg; den moderne atomteori er således ikke baseret på de antikke ideer.[7][8]
Daltons atomteori

I begyndelsen af 1800-tallet analyserede den engelske kemiker John Dalton eksperimentelle data indsamlet af ham selv og andre forskere og opdagede et mønster nu kendt som "loven om de multiple proportioner". Han bemærkede, at når grundstoffer danner forbindelser indbyrdes, vil forholdet mellem vægtmængden af det ene grundstof og vægtmængde af et andet grundstof, som det forener sig med, forholde sig som et helt tal — som ofte et lille tal. Efter opdagelsen af dette mønster foreslog Dalton, at et grundstof kombineres med andre grundstoffer i form af enheder, der indbyrdes har den samme vægt, og han besluttede at kalde disse enheder "atomer".
For eksempel er der to typer tinoxid: den ene er et sort pulver, der er 88,1 % tin og 11,9 % oxygen, og den anden er et hvidt pulver, der er 78,7 % tin og 21,3 % oxygen. Justerer man disse tal, er der i den sorte oxid omkring 13,5 g ilt for hver 100 g tin, og i den hvide oxid er der omkring 27 g ilt for hver 100 g tin. 13,5 og 27 danner et forhold på 1:2. Dalton konkluderede, at i disse oxider er der for hvert tinatom henholdsvis et eller to oxygenatomer tinoxid (SnO) og tindioxid (SnO2).[9][10]
Dalton analyserede også jernoxider. Der er én type jernoxid, som er et sort pulver, som er 78,1% jern og 21,9% oxygen; og der er et andet jernoxid, der er et rødt pulver, som er 70,4% jern og 29,6% oxygen. Justerer man disse tal, er der i den sorte oxid omkring 28 g ilt for hver 100 g jern, og i den røde oxid er der omkring 42 g ilt for hver 100 g jern. 28 og 42 danner et forhold på 2:3. I disse respektive oxider er der for hvert to jernatomer to eller tre iltatomer: jern(II)oxid (Fe2O2; skrives normalt som FeO) og jern(III)oxid (Fe2O3).[11]J.P. Millington (1906). John Dalton. J. M. Dent & Co. (London); E. P. Dutton & Co. (New York).</ref> Romertallene II og III i parentes angiver jernatomets valens.
Niels Bohrs atommodel

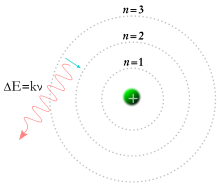
I 1913 foreslog den danske fysiker Niels Bohr en model, hvor elektronerne i et atom blev antaget at kredse om kernen, men kun kunne gøre det i et begrænset sæt af baner og kun kunne springe mellem disse baner som følge af bestemte ændringer af energi svarende til absorption eller stråling af en foton. [12] Denne kvantisering blev brugt til at forklare, hvorfor elektronernes kredsløb er stabile (givet at ladninger i acceleration, inklusive cirkulær bevægelse, normalt mister kinetisk energi, som udsendes som elektromagnetisk stråling, se synkrotronstråling), og hvorfor grundstoffer absorberer og udsender elektromagnetisk stråling i bestemte spektre. [13]
Senere samme år leverede Henry Moseley yderligere eksperimentelt bevis til fordel for Niels Bohrs teori. Disse resultater forfinede Ernest Rutherfords og Antonius van den Broeks model, som foreslog, at atomet i sin kerne indeholder en række positive kerneladninger, der er lig med dets (atomare) nummer i det periodiske system. Indtil disse eksperimenter var atomnummeret ikke kendt som en fysisk og eksperimentel størrelse. At nummeret er lig med den atomare kerneladning er stadigvæk den accepterede atommodel i dag.[14]
Kemiske bindingerer mellem atomer blev forklaret af Gilbert Newton Lewis i 1916, som vekselvirkningerne mellem grundstoffernes elektroner.[15] Eftersom et grundstofs kemiske egenskaber kunne have lighed med andre grundstoffer i henhold til det periodiske system,[16] foreslog den amerikanske kemiker Irving Langmuir i 1919, at dette kunne forklares ved, at elektronerne i et grundstofs atom var forbundet eller grupperet på en eller anden måde, som havde lighed med organiseringen i andre grundstoffer. Således mentes grupper af elektroner at optage et antal elektronskaller omkring kernen.[17]
Bohrs atommodel var den første komplette fysiske model af atomet. Den beskrev atomets overordnede struktur, hvordan atomer binder til hinanden, og forudsagde brints spektrallinjer. Bohrs model var ikke perfekt og blev suppleret af den mere nøjagtige Schrödinger-model, men den var tilstrækkelig til at fjerne tilbageværende tvivl om, at stof er sammensat af atomer. For kemikere havde ideen om atomet været et nyttigt værktøj til at forstå kemiske processer, men fysikere var i tvivl om, hvorvidt stof virkelig består af atomer, da ingen endnu havde udviklet en komplet fysisk model for atomet.
Schrödinger-modellen

Stern-Gerlach-eksperimentet i 1922 gav yderligere bevis på atomegenskabernes kvantenatur. Når en stråle af sølvatomer blev ført gennem et specielt formet magnetfelt, blev strålen opdelt på en måde, der var korreleret med retningen af et atoms vinkelmoment, eller spin. Da denne spin-retning i begyndelsen er tilfældig, forventes strålen at afbøje i en tilfældig retning. I stedet blev strålen opdelt i to retningskomponenter, svarende til, at atomets spin var orienteret op eller ned i forhold til magnetfeltet.[18]
I 1925 udgav Werner Heisenberg den første konsekvente matematiske formulering af kvantemekanikken.[14] Et år tidligere havde Louis de Broglie foreslået pilotbølge-teorien: at alle partikler opfører sig som bølger til en vis grad,[19] og i 1926 brugte Erwin Schrödinger denne idé til at udvikle Schrödingers ligning, en matematisk model for atomet baseret på en alternativ bølgemekanik, der beskrev elektronerne som tredimensionelle bølger snarere end punktformede partikler.[20]
En konsekvens af at bruge bølger til at beskrive partikler er, at det er matematisk umuligt at opnå præcise værdier for både positionen og impulsen af en partikel på et givet tidspunkt. Dette blev kendt som usikkerhedsprincippet, formuleret af Werner Heisenberg i 1927.[14] Ifølge dette princip ville man aldrig kunne måle eksakt, hvor en given elektron befinder sig, men kun kunne angive dens position indenfor et interval af sandsynlige værdier for impuls og omvendt.[21] Denne model var i stand til at forklare observationer af atomær adfærd, som tidligere modeller ikke kunne, såsom visse strukturelle og spektrale mønstre af atomer større end hydrogen. Således blev modellen af atomet, hvor elektronerne bevægede sig som planeter omkring kernen, kasseret til fordel for en, der beskrev en elektronskal som et diffust område, med orbitale zoner omkring kernen, hvor en given elektron med størst sandsynlighed vil kunne blive observeret.[22][23]
Opbygning af et atom
Hvert atom er sammensat af en kerne og en eller flere elektroner der er bundet til kernen. Kernen er lavet af en eller flere protoner og et antal neutroner. Tilsammen kaldes protoner og neutroner for nukleoner. Kun den mest almindelige variant af brint har ingen neutroner.
Kernen er kun ca. en hundredetusindedel af atomets samlede størrelse, men rummer næsten hele atomets masse. Mere end 99,94% af et atoms masse udgøres således af kernen. Protonerne har en positiv elektrisk ladning, elektronerne har en negativ elektrisk ladning, og neutronerne har ingen elektrisk ladning. Hvis antallet af protoner og elektroner er lige store, så er atomet elektrisk neutralt. Hvis et atom har flere eller færre elektroner end protoner, så har det en samlet negativ eller positiv ladning, - sådanne atomer kaldes ioner.
Atomnummeret angiver antallet af protoner i kernen, og definerer hvilket kemisk grundstof atomet tilhører. For eksempel er ethvert atom, der indeholder 29 protoner, kobber. Antallet af neutroner definerer grundstoffets isotop. For eksempel er et kobberatom med 34 neutroner kobber-63 (29+34) (Cu-63) og med 36 neutroner er det kobber-65 (Cu-65); naturligt kobber er omkring 70% Cu-63 og resten er Cu-65.
Et atoms elektroner tiltrækkes af protonerne i atomkernen gennem den elektromagnetiske kraft. Protonerne og neutronerne i kernen tiltrækkes af hinanden gennem kernekraften. Denne kraft er normalt stærkere end den elektromagnetiske kraft, der støder de positivt ladede protoner fra hinanden. Under visse omstændigheder bliver den frastødende elektromagnetiske kraft stærkere end kernekraften. I dette tilfælde deler kernen sig og resulterer i dannelse af nye atomer med en anden masse og ladning, hvilket vil sige nye grundstoffer. Et sådant resultat kaldes for nukleart henfald. Hvis f.eks. et svovlatom (atomnummer 16) spaltes i to lige store dele, vil resultatet være to iltatomer (atomnummer 8) og ikke længere svovl.
Atomer som basis for kemiske forbindelser
Atomer kan binde sig til et eller flere andre atomer ved kemiske bindinger for at danne kemiske forbindelser såsom molekyler eller krystaller af salte. For eksempel var tårnene på mange af vores slotte oprindeligt lavet af rent kobber, men i årenes løb blev overfladen kombineret med ilt-, kulstof- og svovlatomer for at lave en grøn patina kalder ir på kobberet. Atomers evne til at binde sig til hinanden i kemiske forbindelser er ansvarlig for de fleste af de fysiske ændringer, der observeres i naturen. Kemi er den disciplin, der studerer disse ændringer.
Notation

Atomkernen i et grundstof med nukleoner og protoner skrives som . Fx skrives carbon-14 som eller ofte blot .
Neutrontallet er ikke nødvendigt at have med i denne notation, men er relateret til de andre tal ved:
Referencer
- ^ den store danske: atom; https://denstoredanske.lex.dk/atom
- ^ den danske ordbog: atom; https://ordnet.dk/ddo/ordbog?query=atom
- ^ a b Demokrit - Den Store Danske
- ^ Barnes, Jonathan (1987). Early Greek Philosophy (engelsk). Penguin Books. ISBN 978-0-14-044461-2. Hentet 8. september 2022.
- ^ a b c Berryman, S. (2016) Democritus. The Stanford Encyclopedia of Philosophy, 2. december 2016. Hentet 10. november 2022.
- ^ Russell, Bertrand (1972). A History of Western Philosophy (engelsk). Simon and Schuster. s. 64-65. ISBN 978-0-671-31400-2. Hentet 8. september 2022.
- ^ Pullman, Bernard (1998). The Atom in the History of Human Thought. Oxford, England: Oxford University Press. s. 31-33. ISBN 978-0-19-515040-7. Arkiveret fra originalen 5. februar 2021. Hentet 25. oktober 2020.
- ^ Andrew G. van Melsen (2004) [1952]. From Atomos to Atom: The History of the Concept Atom. Oversat af Henry J. Koren. Dover Publications. s. 18-19. ISBN 0-486-49584-1.
- ^ John Dalton (1817). A New System of Chemical Philosophy vol. 2. s. 36.
- ^ Melsen (1952). From Atomos to Atom, p. 137
- ^ Dalton (1817). A New System of Chemical Philosophy vol. 2, pp. 28
- ^ Stern, David P. (16. maj 2005). "The Atomic Nucleus and Bohr's Early Model of the Atom". NASA/Goddard Space Flight Center. Arkiveret fra originalen 20. august 2007.
- ^ Bohr, Niels (11. december 1922). "Niels Bohr, The Nobel Prize in Physics 1922, Nobel Lecture". Nobelstiftelsen. Arkiveret fra originalen 15. april 2008.
- ^ a b c Pais, Abraham (1986). Inward Bound : Of Matter and Forces in the Physical World. New York: Oxford University Press. s. 228–230. ISBN 978-0-19-851971-3.
- ^ Lewis, Gilbert N. (1916). "The Atom and the Molecule". Journal of the American Chemical Society. 38 (4): 762-786. doi:10.1021/ja02261a002. ISSN 0002-7863. S2CID 95865413. Arkiveret (PDF) fra originalen 25. august 2019.
- ^ Scerri, Eric R. (2007). The periodic table: its story and its significance. Oxford University Press US. s. 205–226. ISBN 978-0-19-530573-9.
- ^ Langmuir, Irving (1919). "The Arrangement of Electrons in Atoms and Molecules". Journal of the American Chemical Society. 41 (6): 868-934. doi:10.1021/ja02227a002. Arkiveret fra originalen 21. juni 2019.
- ^ Scully, Marlan O.; Lamb, Willis E.; Barut, Asim (1987). "On the theory of the Stern-Gerlach apparatus". Foundations of Physics. 17 (6): 575-583. Bibcode:1987FoPh...17..575S. doi:10.1007/BF01882788. S2CID 122529426.
- ^ McEvoy, J. P.; Zarate, Oscar (2004). Introducing Quantum Theory. Totem Books. s. 110–114. ISBN 978-1-84046-577-8.
- ^ Kozłowski, Miroslaw (2019). "The Schrödinger equation A History".
- ^ Chad Orzel (16. september 2014). "What is the Heisenberg Uncertainty Principle?". TED-Ed. Arkiveret fra originalen 13. september 2015 – via YouTube.
- ^ Brown, Kevin (2007). "The Hydrogen Atom". MathPages. Arkiveret fra originalen den 20. november 2022. Hentet 11. november 2022.
{{cite web}}: CS1-vedligeholdelse: BOT: original-url status ukendt (link) - ^ Harrison, David M. (2000). "The Development of Quantum Mechanics". University of Toronto. Arkiveret fra originalen 25. december 2007.
Eksterne henvisninger
- https://portals.clio.me/dk/fysikkemi/emner/stof-kredsloeb/fysikkemi/atomer/
- https://www.anisotropela.dk/encyclo/atom_dk.html
- http://www.holismen.dk/Naturfag/Atomer/Atomer.htm
Atommodeller
En atommodel er en model til beskrivelse af atomets opbygning.
Se også
- Fysik
- Partikelfysik
- Subatomar partikel
- Proton
- Neutron
- Elektron
- Foton
- brintatomet
- Atommodel (Bohr)
- Atommodel (bølge)
Noter
Medier brugt på denne side
Forfatter/Opretter: Geek3, Licens: CC BY-SA 4.0
Atomic hydrogen-like single-electron orbital showing , also called 3dxz-orbital for its alignment in xz-direction. The image is a 3D rendering of the spatial density distribution of |𝜓|² with the color depicting the phase of 𝜓. The spatial distribution is smooth and vanishes for large radii. The cloud is a more realistic representation of an orbital than the more common solid-body approximations. At full resolution, 1Å=11px.
Forfatter/Opretter: Zygimantus, Licens: CC BY-SA 4.0
A chemical element X and his mass (A) and atomic (Z) numbers.
Forfatter/Opretter: User:Yzmo, Licens: CC BY-SA 3.0
A depiction of the atomic structure of the helium atom. The darkness of the electron cloud corresponds to the line-of-sight integral over the probability function of the 1s atomic orbital of the electron. The magnified nucleus is schematic, showing protons in red and neutrons in purple. In reality, the nucleus (and the wavefunction of each of the nucleons) is also spherically symmetric and 1s, and the four particles, each with a different quantum number, like the electrons in the helium atom, are all most likely to be found in the same space, at the exact center of the nucleus. (For more complicated nuclei this is not the case. Thanks to Åke Back.)
Forfatter/Opretter: Kurzon, Licens: CC BY-SA 3.0
A simple illustration of Bohr's model of the atom, with an electron making quantum leaps.
Two pages from John Dalton's 1808 book A New System of Chemical Philosophy in which he proposed his version of atomic theory based on scientific experimentation.






